
根据药融云数据库统计,2023.07.31-2023.08.06 期间共有 52 个创新药/改良型新药注册申请获 CDE 承办 (按受理号统计,不含补充申请)。其中,国产药品受理号 37 个,进口药品受理号 15 个。 共计 18 款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药 11 款,生物药 7 款,无中药。
有1 款创新药/改良型新药获批上市,即甲磺酸贝舒地尔片。8 月 3 日,NMPA 发布药品批准证明文件送达信息显示,NMPA 批准烨辉医药的甲磺酸贝舒地尔片上市,用于治疗对糖皮质激素或其他系统治疗应答不充分的 12 岁及以上慢性移植物抗宿主病(cGVHD)患者。

截图来源:NMPA官网
公开资料显示,甲磺酸贝舒地尔片是一款 ROCK2 激酶抑制剂,ROCK2 介导的信号通路在调节炎症和纤维化反应中具有重要作用。甲磺酸贝舒地尔片能通过减轻 STAT3 的磷酸化,加强 STAT5 的磷酸化,从而下调过度活化的 T 辅助细胞(Th17),并增强调节性 T 细胞(Treg)功能,进而重建免疫平衡。
这是中国首个获批用于该适应症的靶向治疗,也标志着医学界的一个重要里程碑,因为cGVHD是一种危及生命的疾病,目前治疗手段却非常有限。乐舒克在美国、英国、加拿大和澳大利亚等国家均已获批上市,商品名为REZUROCK。
部分获批临床创新药/改良型新药信息速览(不含补充申请)
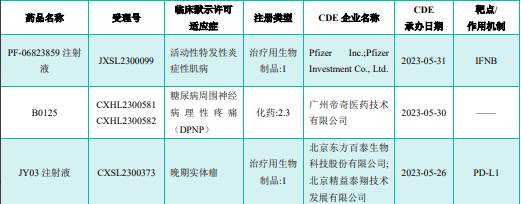
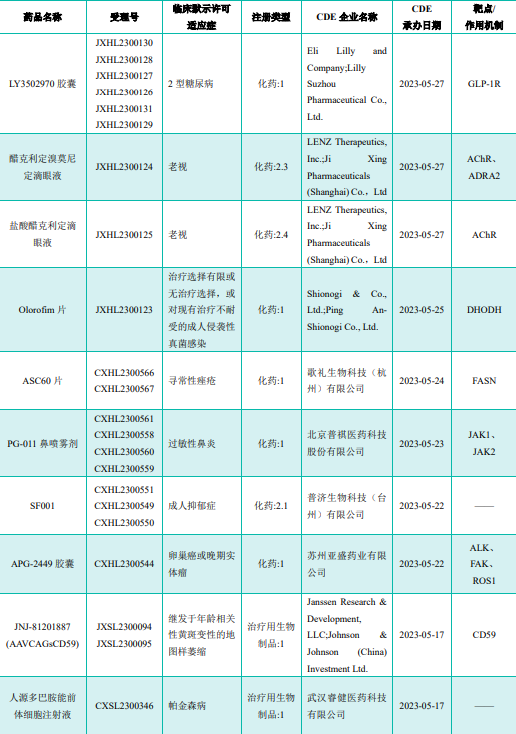
图片来源:《药融云医药行业观察周报》
注:此处所列创新药/改良型新药,主要是指CDE受理批准的 1 类、2 类、5.1 类以及生物制品 3.1 类和 3.2 类。想要获取《药融云医药行业观察周报》完整获批临床信息及研发进展详情等,可关注公众号“药融云”,后台回复关键词“报告”进行领取。
1. JY03 注射液-拟用于治疗晚期实体瘤
JY03 是基于东方百泰的抗体研发平台以 LAG-3 为靶点研发的人源化单克隆抗体药物,能够特异性结合 T 细胞表面 LAG-3 靶点,阻断其与配体 MHCII 的结合, 进而阻断细胞内信号通路的传导,重新激活免疫细胞并释放细胞因子,提高免疫应答的敏感度从而发挥抗肿瘤作用,拟用于治疗晚期实体瘤。
截图来源:药融云中国临床试验数据库
肿瘤领域也是一大热门赛道,据药融云数据库显示,从2014年开始到2022年,销售额都呈递增状态,2021年院内销售额22亿元,同比增长33%。国内也有众多药企争相布局:齐鲁制药的注射用QLF3108、迈威(上海)生物科技股份有限公司(后续简称迈威生物)的9MW2921、信达生物制药的IBI354、苏州泽璟生物制药的注射用ZG006等药物都在临床1-3期实验阶段中。
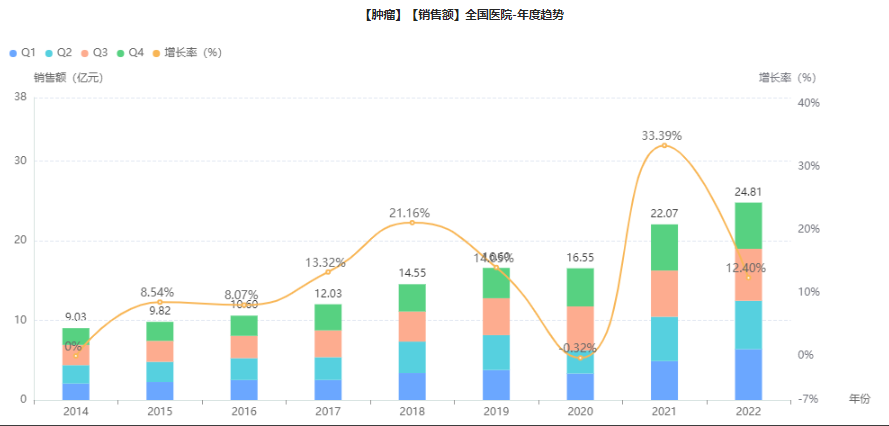
截图来源:药融云全国医院销售数据库
据药融云数据库,在过去的十年中,肿瘤研发管线逐渐聚焦于靶向药物,并且具有创新作用机制的新治疗模式得到快速发展。以PD-1/PD-L1抑制剂药物为例,虽然2022年的管线数量有所下降,但近五年来相关临床试验的启动数量仍然增长了54%。大多数进行中的PD-1/PD-L1晚期药物临床试验集中在单个国家,尤其是中国,这意味着这些正在试验中的药物不一定面向国际市场。同时,双特异性抗体疗法、抗体偶联药物以及包含细胞疗法和RNA癌症疫苗在内的新一代生物疗法正在迅猛增长。
2. 人源多巴胺能前体细胞注射液-拟用于治疗帕金森病
8月2日,武汉睿健医药的人源多巴胺能前体细胞注射液获得临床试验默示许可,拟用于治疗帕金森病。
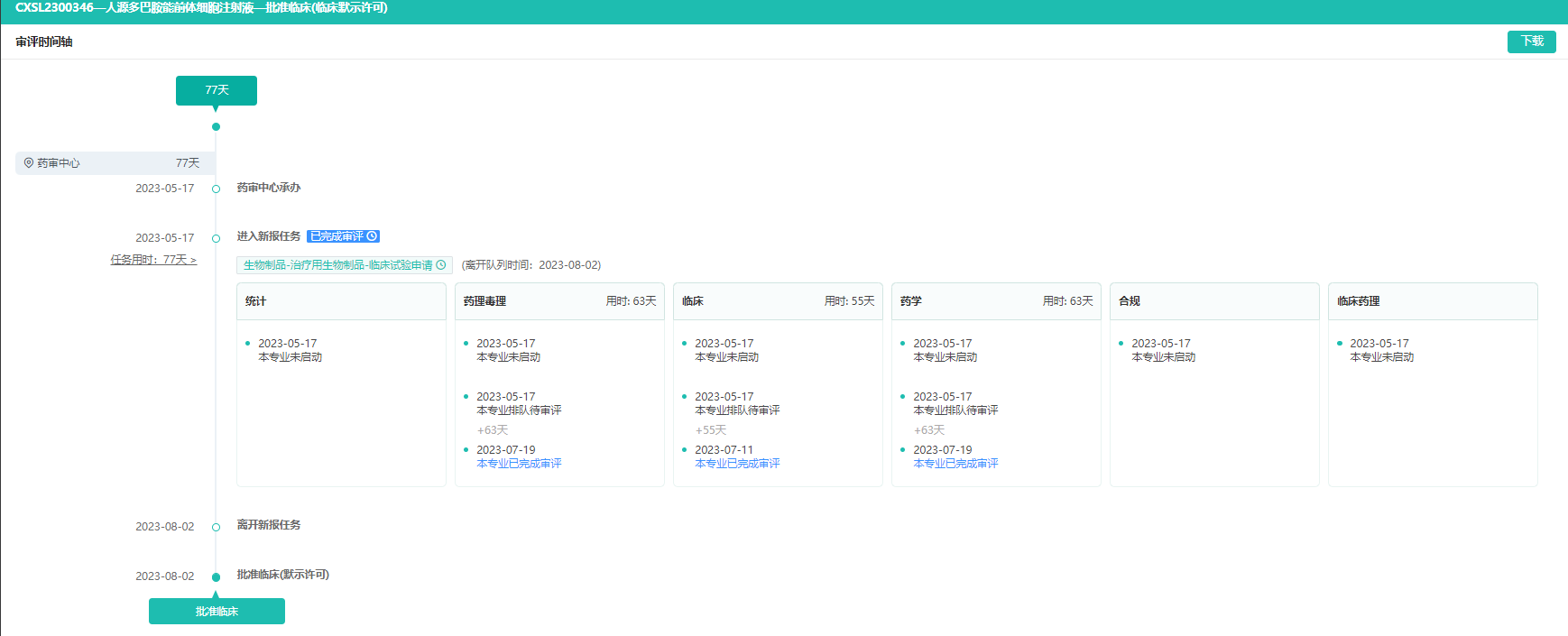
截图来源:药融云中国药品审评数据库
帕金森病(PD)是一种常见的神经功能障碍疾病,主要影响中老年人,多在60岁以后发病。其症状表现为静止时手,头或嘴不自主地震颤,肌肉僵直、运动缓慢以及姿势平衡障碍等,导致生活不能自理去。目前我国约有300万帕金森病患者,65岁人群中患病率约为1.7%,世界卫生组织专家预测,到2030年,我国帕金森病患者将达到500万。全球将有900-1000万帕金森病患者。
而睿健医药的“人源多巴胺能前体细胞注射液”是通过其自研的高效化学小分子诱导功能细胞再生技术开发的一款针对帕金森病(PD)的iPSC衍生药物。人源多巴胺能前体细胞注射液通过化合物调节实现高纯度神经元亚型分化,与体内原有神经元形成连接,并增强细胞分泌功能,进一步加强了移植细胞对原有病灶的改善,以达到综合性的治疗效果,改善PD症状。
3. LY3502970胶囊-礼来口服小分子GLP-1R激动剂
CDE官网显示,礼来每日1次口服小分子GLP-1R激动剂LY3502970胶囊(Orforglipron)的临床试验申请获默示许可,适应症为:减重。
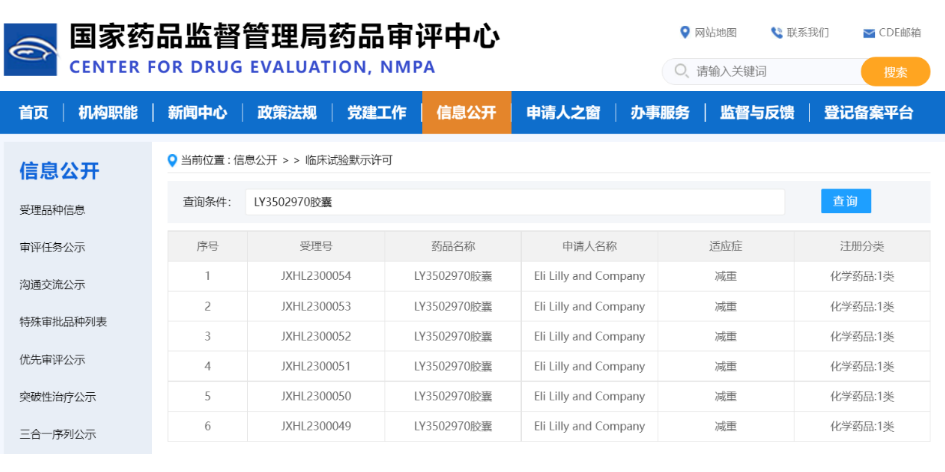
截图来源:CDE官网
LY3502970胶囊是一款新型、高效、口服的非肽类GLP-1R激动剂,最初由Chugai开发。2018年9月,礼来与Chugai达成协议,获得LY3502970的全球开发和商业化权益。目前,礼来正在开展LY3502970针对2型糖尿病和肥胖的III期研究。
LY3502970全球研发进度查询
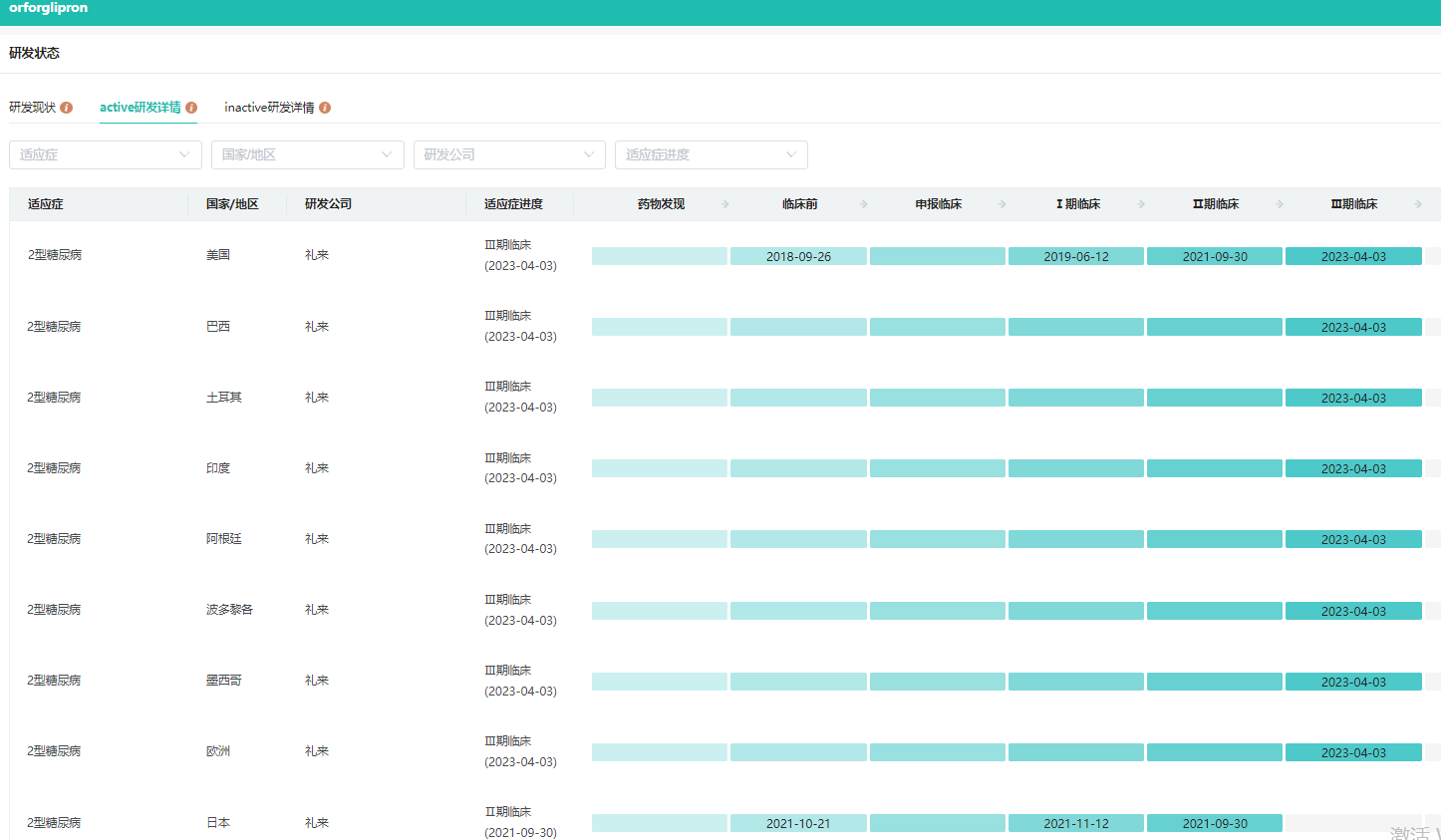
截图来源:药融云全球药物研发数据库
LY3502970的I期研究结果显示,LY3502970每日一次治疗显示出与GLP-1R激动剂注射制剂相当的安全性、强效的降糖疗效以及显著的减重效果。胰高血糖素样肽-1受体(GLP-1R)被誉为百年难得一遇的优质靶点,在糖尿病、减肥甚至心脑血管、神经退行性疾病领域都拥有广阔的开发潜力。
近期,礼来(Eli Lilly and Company)和Sigilon Therapeutics联合宣布,双方已达成协议,礼来将斥资逾3亿美元收购Sigilon。Sigilon致力于针对广泛急性和慢性疾病开发功能性治愈疗法,其中包括与礼来合作开发,用于治疗1型糖尿病的封装细胞疗法。该公司在2018年就与礼来公司达成研发合作,开发治疗1型糖尿病患者的封装细胞疗法。1型糖尿病患者需要接受终生护理,包括通过每日多次注射或使用泵持续输注胰岛素。
<END>
想要获取《药融云医药行业观察周报》完整报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往药融云“药融文库”网站【原创报告】栏目进行全文下载。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论