
2016年03月国家药品监督管理局药品审评中心发布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》指导原则指出“调释制剂若以下条件全部满足,则可以认为调释制剂的其他规格与相应规格的参比制剂具有生物等效性:1)其他规格制剂的活性和非活性组分组成比例与试验规格的受试制剂相似;2)其他规格制剂的释药原理与试验规格的受试制剂相同;3)各规格制剂体外溶出试验结果相似。建议至少在3种不同pH溶媒(例如pH1.2,4.5和6.8)中通过f2值判断其他规格的溶出曲线与生物等效性研究中受试制剂溶出曲线的相似性。”
而本指导原则中指出的“其他规格制剂的活性和非活性组分组成比例与试验规格的受试制剂相似”在2022年02月国家药品监督管理局药品审评中心发布的《对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)》中有明确的解答。
对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(试行)中指出“对于调释制剂:“组成比例相似”包括以下情况:①不同规格之间所有非活性成分与活性成份的比例完全相同;②不同规格之间非活性成分与活性成分的比例不完全相同,如申请人申请豁免,应证明比例是合理的,且与产品的药物释放机制相适应。审评期间基于整体资料进行综合评估。”说明对于调释制剂,如果大规格制剂已通过BE试验,而小规格制剂想要豁免BE,则必须满足上述的三点要求,其中一点是必须满足不同规格之间所有非活性成分与活性成份的比例完全相同。
我们在做药品多规格膜控型调释制剂研发时常常遇到这样的问题,大规格制剂已通过BE试验,新增小规格制剂可申请BE豁免,小规格制剂的处方与大规格制剂保持一致,处方量是在大规格制剂处方基础上进行等比例递减得到。但是小规格制剂的溶出度比大规格制剂快,致使小规格制剂与BE规格制剂在各介质中溶出曲线不相似。
发生这种情况有2种原因。1、出现这种情况是由于原料药属于BCSⅡ,在各介质中呈pH依赖性,在某些介质中溶解度较小,大规格制剂进行溶出时没有达到漏槽条件,而小规格制剂则达到或接近漏槽条件,从而造成小规格制剂在某些介质中的溶出较大规格制剂快。根据“GUIDELINE ON THE INVESTIGATION OF BIOEQUIVALENCE中At pH values where sink conditions may not be achievable for all strengths in vitro dissolution may differ between different strengths. However, the comparison with the respective strength of the reference medicinal product should then confirm that this finding is drug substance rather than formulation related. In addition, the applicant could show similar profiles at the same dose (e.g. as a possibility two tablets of 5 mg versus one tablet of 10 mg could be compared)”(在不可能对所有规格都达到漏槽条件的pH值下,不同规格制剂的体外溶出可能不同。
然而,与参比制剂的各规格制剂进行比较应确认这一情况与原料药有关,而与制剂无关。此外,申请人可以在相同剂量下表明类似的情况(例如,可以比较两片5mg片和一片10mg片的可能性))的描述。则在溶出偏快的介质中投入两片小规格制剂,若此时溶出趋势和大规格制剂一致,则不需进行处方调整,因其是原料药自身性质造成的。2、在排除了是原料药自身溶解度的因素后,造成小规格制剂溶出度大的原因就是制剂因素。片子由原来的大片子变成了小片子,同样批量的小片子的比表面积增加,而大规格制剂和小规格制剂的包衣液在处方中的比例却保持不变,故小规格制剂每片的包衣厚度变薄了,导致溶出变快,用下表格中3个规格制剂举例:
表1:3个不同规格处方组成
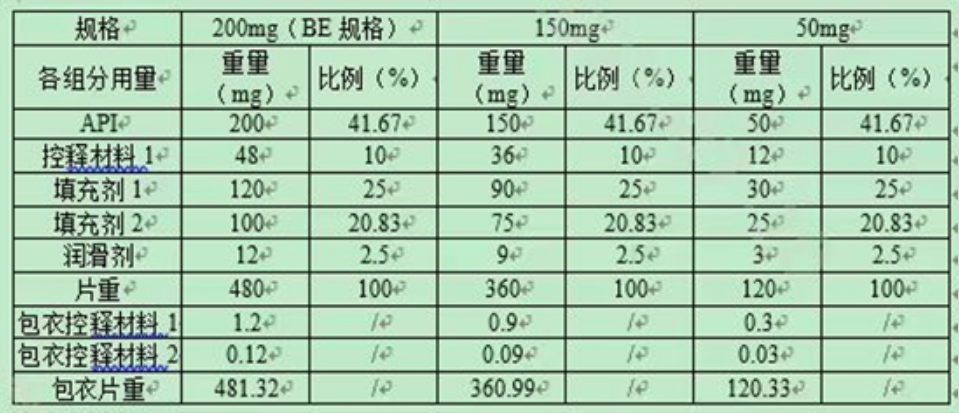
上表中200mg规格为BE规格。拟申请豁免50mg、150mg规格与BE规格的所有活性和非活性组分组成比例完全相同,属于调释制剂“不同规格之间所有活性和非活性组分组成比例完全相同”,结合BE规格制剂符合生物等效性要求,两个规格制剂与BE制剂释药原理相同,且两个规格与BE规格仿制药在三种pH介质中体外溶出曲线相似的前提条件,可以豁免50mg、150mg规格的BE试验。
解决此问题已经不能从处方上调整,只能从工艺入手使小规格制剂的溶出减慢,可以分两三步来控制,1、在设计片子大小时,尽量使用直径比较大的模具进行压片,以减少因比表面积的因素造成的溶出变快。2、在素片阶段控制,若制粒工艺为湿法制粒,则在制粒步骤中可以考察搅拌桨转速、制粒刀转速及制粒时间对溶出的影响,根据结果选择合适的参数作为最终制粒参数;在压片步骤考察不同硬度对溶出的影响,根据结果选择合适的硬度作为最终的硬度进行控制。3、在膜控阶段进行控制,对于缓控释制剂来说,包衣材料需要达到最低成膜温度,在薄膜形成过程中,衣膜逐渐融合直至薄膜的孔隙消除后达到终点,才能在片剂或者微丸表面铺展和相互结合,发挥其缓控释作用。
衣膜融合可通过包衣过程完成,也可在包衣结束后通过短暂的老化过程完成,因此在对素片进行包衣阶段,可延长干燥时间,使包衣处方能得到完整且进一步的衣膜融合,以达到减慢溶出的目的。下表是50mg规格包衣后不同干燥时间与200mg规格(BE规格)的溶出对比:
表2: 50mg规格包衣后不同干燥时间与200mg规格(BE规格)的溶出对比
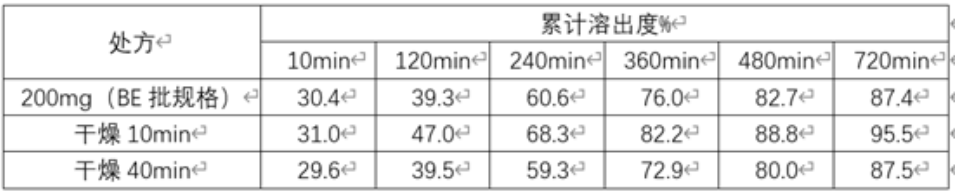
从上表中可以看出,干燥时间越久,溶出越慢,与大规格制剂BE批越相似。4、在包衣阶段,通过调整各包衣参数,使包衣过程中相对湿度升高,这样会使包衣膜更致密,从而使溶出减慢。下表3、表4是50mg规格包衣过程中不同相对湿度的包衣具体参数,表5是50mg规格包衣过程中不同相对湿度与200mg规格(BE规格)的溶出对比:
表3: 低的包衣相对湿度的包衣具体参数

表4 :高的包衣相对湿度的包衣具体参数
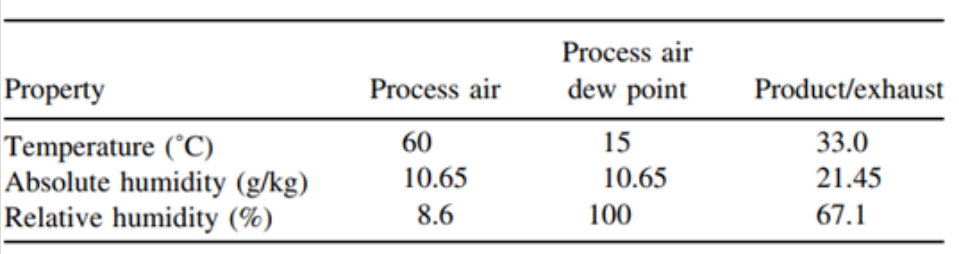
表5 :50mg规格包衣过程中不同相对湿度与200mg规格(BE规格)的溶出对比
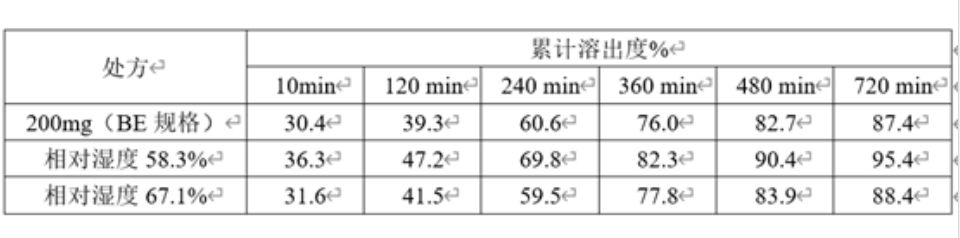
从上表中可以看出,包衣相对湿度越高,溶出越慢,与大规格制剂BE批越相似。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论