
总部位于新加坡的SCG Cell Therapy Pte Ltd(简称SCG)宣布,美国FDA已批准SCG101的新药临床研究(IND)申请。SCG101是一种用于乙型肝炎病毒(HBV)相关肝癌患者的在研T细胞受体(TCR)T细胞疗法。这一疗法启动了SCG101 1/2期临床试验在全球范围内的进展。
此前,SCG于2022年3月获得中国国家药品监督管理局(NMPA)和2022年5月获得新加坡卫生科学局(HSA)的IND批准,进一步确立了SCG101作为首个在美国、中国和新加坡批准进行临床试验的TCR-T细胞治疗产品。
“在美国和亚洲,SCG领先的细胞治疗产品SCG101的IND许可是该公司的一个重要里程碑,”SCG细胞治疗首席执行官Frank Wang说,“我们渴望启动国际多中心临床试验,利用我们的TCR-T技术为患者提供创新的治疗选择。”
SCG细胞疗法首席科学官Ke Zhang博士说:“我们之前的临床前和临床研究表明,SCG101具有抗病毒和抗肿瘤双重活性,这是SCG在癌症药物开发中极其重要和令人兴奋的临床概念验证,我们相信肿瘤微环境是实体瘤细胞治疗成功的主要障碍。将T细胞特异性地针对HBsAg阳性HCC细胞以及HBV感染的细胞进行定向,可能会诱导免疫级联反应,改变肿瘤微环境,并为患者提供更好的结果。”
2022年6月,SCG在2022年国际肝脏大会(ILC)上展示了研究者发起的SCG101临床试验的中期数据。该试验评估了单剂量SCG101在晚期HBV相关肝细胞癌(HCC)患者中,这些患者之前至少接受过2种癌症治疗。数据显示,三分之二的患者在SCG101治疗后的短短28天内观察到病灶缩小,以及血清HBsAg从基线1004.3 IU/mL和521.6 IU/ML迅速降低至23.8 IU/mL和9.1 IU/mL,并在治疗后60天内进一步降至14.0 IU/m和0.3 IU/mL。
关于SCG101
SCG101是一种靶向HLA 的TCR-T细胞疗法,是一种针对乙型肝炎表面抗原(HBsAg)特异性表位的研究性细胞治疗产品,可以识别由特定的主要组织相容性复合物(MHC)I类分子呈现在细胞表面的HBV衍生的T细胞表位。SCG101结合了SCG的专有技术,该技术允许使用具有高灵敏度和亲和力的病毒特异性TCR对功能失调的感染细胞和肿瘤细胞进行重定向和工程设计。通过特异性HLA分型,SCG101可以特异性地将T细胞重定向到HBV抗原,不仅可以靶向和消除HBsAg阳性HCC细胞,还可以根除HBV cccDNA(共价闭合的环状DNA)。
SCG101药物基本信息
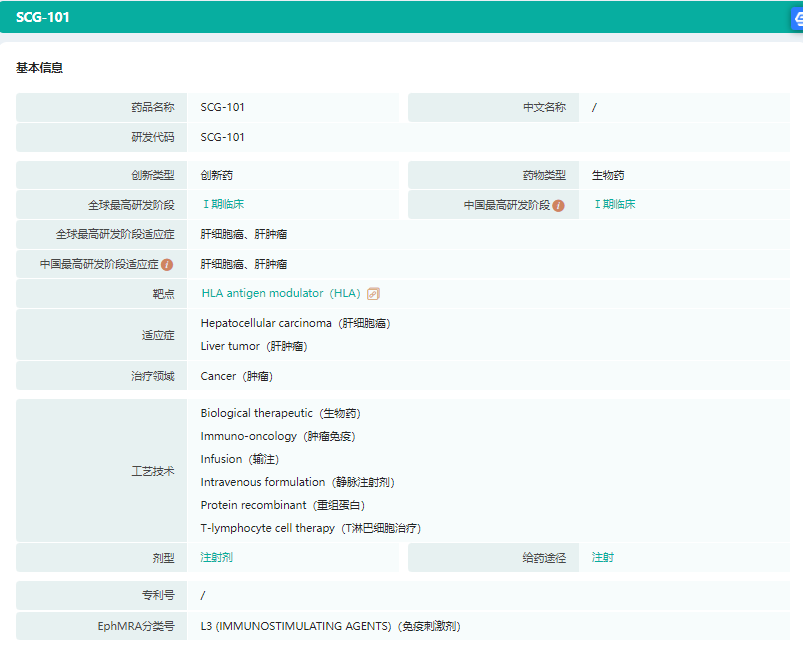
截图来源:药融云全球药物研发数据库
关于SCG
SCG是一家领先的生物技术公司,专注于开发用于感染及其相关癌症的新型免疫疗法。该公司以最常见的致癌感染为目标:幽门螺杆菌,人瘤病毒和乙型肝炎,并开发了广泛而独特的 T 细胞疗法,抗体和治疗性感染疫苗的管道,以预防和治愈其相关癌症。SCG成立于新加坡,总部位于新加坡,结合了新加坡,中国和德国的区域优势,涵盖了从创新药物研发,制造,临床开发和商业化的整个价值链。SCG与领先的科学家和研究人员合作,带来一流和一流的医疗产品/技术,以加强医疗产品开发的创新。
参考信息:
https://www.wcrf.org/cancer-trends/liver-cancer-statistics/
药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论