
近期,东阳光药业芬戈莫德胶囊在美国挑战原研专利成功,首仿上市的消息获得广泛报道。作为国内坚定奉行国际化战略并走在国际化前列的药企,取得这样的成绩可谓实至名归。要知道成功挑战原研专利并不是一件轻松的事情,特别是对于国内药企来说,以往成功的案例并不多。从公开报道看东阳光药业从开始布局(2011年7月立项)到成功挑战原研专利获得在美国市场销售资格(2022年10月)历时11年有余,可谓十年磨一剑。在为东阳光药业骄傲的同时,个人有一些关于美国首仿药制度及如何规避原研专利方面的疑惑,带着这些疑惑在查阅了部分资料后整理出来了个人的一些思考,在此和大家一起探讨。
东阳光药业芬戈莫德首仿药能否获得180天市场独占权?
美国Hatch-Waxman法案规定,第一个向美国FDA递交ANDA、并含有PIV声明的仿制药申请者,如果专利挑战成功,则FDA将给予180天的市场独占期。根据FDA法规规定,这里的第一个提出ANDA申请,最早可以在NCE-1日申报(市场独占期减一年),也即新药上市后满4年,比NCE时间少了1年,因此称为NCE-1日,该日期通常被认为是首仿日。如果有多家药企同时在这一天递交ANDA,并且提出第IV段声明并合法维持(lawfully maintain)该声明的条件,都可享有首仿药资格。芬戈莫德胶囊原研美国获批时间为2010年9月21日,东阳光药业于2014年9月21日附带PIV专利声明向美国FDA提交ANDA首仿申请,随后向原研诺华发出挑战书,并且最后也以合法维持该声明的条件获得首仿,可见这些前置条件是满足的,那是否代表可以获得180天市场独占权?
美国的首仿药独占权相对容易获得,但易导致滥用。为此,2003年美国国会通过《医疗保险现代化法案》(Medicare Modernization Act,MMA)对Hatch-Waxman法案进行了修正,增加了独占权丧失条款。具体包括以下六种情形:(1)ANDA申请者在向FDA 提交申请后的30 个月内未获得临时批准;(2)在ANDA 申请获批后的75 天没有上市;(3)ANDA 申请撤销;(4)修改专利声明;(5)所有专利到期;(6)与另一仿制药申请人,原研药上市持有人,或专利权利人达成反竞争协议。
根据上述规定,东阳光药业的芬戈莫德胶囊应在2017年3月21日前获得FDA的临时批准才能享有独占权,但公开信息显示FDA直到2019年12月才批准东阳光的仿制药申请,该批准日期已过了享有首仿独占期的条件,东阳光药业因此遗憾错失市场独占期。
其他获批仿制药厂家是否可以搭乘东阳光药业的顺风车一起上市销售?
FDA橙皮书公开的批准信息可知,芬戈莫德胶囊在美国获批的仿制药厂家达14家,其中包括需多国际知名仿制药企业,也包括国内的华海药业。从公开报道看向原研发起专利挑战的不只东阳光药业一家,但是最终坚持到最后的只有东阳光药业,而且是以东阳光药业成功无效原研专利结局。那么在东阳光药业成功无效掉原研专利的情况下,其他仿制药企业是否可以坐享其成,同步上市销售自家的仿制药产品?
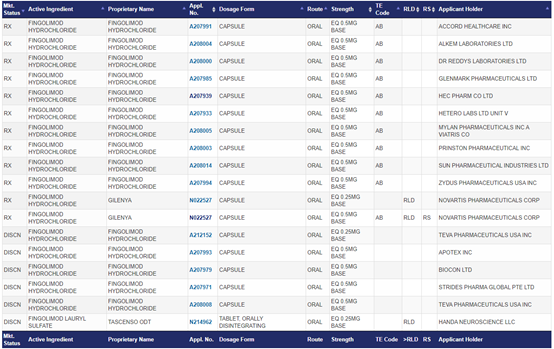
表1.(来源FDA网站)
据公开报道有部分企业当初申报也是选择专利挑战的策略。比如围绕405号专利,诺华曾与包括Teva、Sun在内的多家仿制药企展开专利侵权与无效纠纷。后来,多家仿制药企与诺华达成和解协议,承诺在特定情况下在给药方案专利到期之前或更早的约定日期推出 Gilenya (芬戈莫德胶囊商品名)的通用版本,只有东阳光药业坚持对诺华发起专利挑战。可见如果之前仿制药企业选择挑战原研专利最后又与诺华达成和解协议的,上市计划只能根据签到的和解协议来。一个例子是华海药业的芬戈莫德胶囊仿制药于今年9月份获得FDA的最终批准,华海药业对外发布的公告称本次芬戈莫德胶囊获得正式批准标志着公司具备了在美国市场销售上述产品的资格,公司会根据与原研公司达成的协议进行商业化。但如果有部分企业没有选择PIV专利声明,而是选择PIII声明,即在相关专利失效前不要求FDA批准该仿制药,那么现在随着原研专利被无效,同步上市销售自家的仿制药个人觉得法规上是允许的。
橙皮书中剩余仍处于生效状态的专利东阳光药业将如何规避?
据FDA橙皮书显示,当前诺华登记的专利有三项,分别简称283、405、179号专利,其中283号专利是组合物专利,405号专利是一件新用途专利,涵盖了芬戈莫德的给药方案,179号专利是一件给药方法专利。公开报道显示283和405号专利,先后被成功无效,但是对于179号专利尚没有被成功挑战的报道。
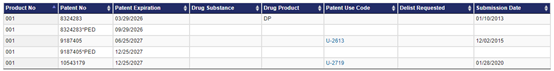
表2.(来源FDA网站)
179号专利共四项权利要求,主要保护了一种治疗可能有感染水痘带状疱疹病毒感染风险的RRMS(复发缓解型多发性硬化)患者的方法。另,芬戈莫德的说明书警告和预防措施(WARNINGS AND PRECAUTIONS)中提到“在开始使用GILENYA之前,测试患者的水痘带状疱疹病毒(VZV)抗体;建议在开始使用GILENYA治疗之前对抗体阴性患者进行VZV疫苗接种”。那么在179号专利尚处于有效状态的情况下,东阳光药业提前上市仿制药会导致侵权吗,东阳光药业有何规避策略?
推测东阳光药业可能的应对策略有两个,一方面继续对179号专利发起无效宣告申请,一方面实施“缩减药品标签”策略。179号专利当初被授权时即面临较大的争议,这件专利既没有公开任何数据,也没有临床试验、测试或者关于本发明的证据。为了获得这件专利权,诺华与美国专利局“较量”了几个来回。核心争议是这件专利是否具有显而易见性。经过诺华的不懈努力,最终审查员做出妥协,认可现有技术没有教导给未患水痘的患者接种水痘疫苗可以降低感染水痘的风险,即该专利申请不具有显而易见性,可以获得授权。因此,推测东阳光药业可能会对该专利继续发起无效。在进攻的同时,东阳光药业有可能也会考虑防守,即实施“缩减药品标签”策略,在其仿制药说明书中删除关于179号专利涉及治疗可能有感染水痘带状疱疹病毒感染风险的RRMS(复发缓解型多发性硬化)患者给药方法的描述。根据《Hatch-Waxman法案》,ANDA的申请人可以根据第505(j)(2)(A)(viii)(又称第viii 条声明(section viii statement))提交声明缩减药品标签。但目前公开报道的缩减药品标签主要针对橙皮书中列出的仍在专利保护期的原研药新适应症,是否可以针对给药方法尚不确定。因为东阳光药业的芬戈莫德胶囊刚在美国上市,公开渠道尚没有查询到其标签信息。
小结
以上是关于东阳光药业芬戈莫德胶囊成功挑战专利首仿上市个人的一些疑惑与思考。在美国挑战专利需要强大的技术实力和资本支撑,据公开报道目前美国进行专利挑战的诉讼成本高达500万美元,选择专利挑战的成本是高昂的。中国仿制药企业想要争夺美国仿制药市场,首先必须要深入了解与研究美国的相关药品专利法律保护制度;其次要重点关注目标药物的相关专利,根据实际的利益权衡,选择合适的仿制药申请策略。相信随着中国药企研发与技术创新能力的不断提升、研发项目管理能力的不断优化、药物细分领域产品定位能力的不断清晰, 以及中国药企实施“走出去” 的国际化进程的决心,中国药企完全可以慢慢拉近与国外大型仿制药企业的距离,在竞争激烈的美国仿药市场上分得一杯羹。
参考文献:
1. FDA网站
2. 东阳光首仿专利挑战成功,芬戈莫德胶囊获批美国上市销售
3. 林淘曦, 余娜, 黄璐. 美国首仿药制度及专利挑战策略研究[J]. 中国新药杂志, 2016, 25(19): 2168-21734. “芬戈莫德”专利无效案反转,对诺华有什么影响?
5. 霍春芳, 吕霖, 李慧. 美国仿制药专利挑战制度及策略[J]. 中国发明与专利, 2017, 14(11): 28-33.
6. 仿制药突破原研药适应症专利的上市策略与风险
7. Can Novartis’ new chicken-pox patent protect Gilenya from generic competition?
8. 石药首仿获批被起诉,东阳光专利挑战成功,二者究竟有何区别?
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论