
近年来,无定形固体分散体(ASD)在提高水溶性差的药物的口服生物利用度方面展现了巨大的潜力,以至于开发ASD以增加溶解度限制吸收药物,一直为制药界所津津乐道。与结晶的多晶型药物相比,ASD使API由晶态转变为分子无序,高自由能,较小粒度,较高的表面积以及较高的润湿性的无定形态,提供更快的溶出速率和更高的表观溶解度。其他药物增溶策略,如助溶剂或自乳化药物递送系统等液体或半固体剂型,其制造成本高,表面活性剂和/或溶剂含量过高,有时可能无法被监管机构接受。
当然,开发ASD也是具有巨大的挑战,其中最突出的问题是ASD缺乏热力学稳定性。通常用于克服无定形活性药物成分的稳定性问题的方法之一是将它们与药学上可接受的聚合物一起配制以形成ASD。形成分子间相互作用(氢键、离子相互作用或偶极-偶极相互作用)的能力是形成无定形分子分散体的最重要标准之一。API与聚合物在完全混溶的情况下,API分子的分子迁移率降低和/或通过API-聚合物相互作用抑制成核和晶体生长,保证了ASD的物理稳定性。这样伴随着ASD在难溶性药物开发中的突出优势和ASD开发中尖锐问题的解决,也让ASD增溶策略在“增溶界”脱颖而出。
针对固体分散体的开发,目前作者已经发表系列文章。诚如文章所说,作者也是摸着石头过河,一边通过自学经典书籍及代表性论文,一边理论联系实际,指导组内项目开发。某一日手底痒痒,洋洋洒洒几万字也跃然于纸上,不知不觉中已经十来篇小文见于纸端。当然学艺自然不甚精通,还请指导,书文如下:
以上谈过了什么使固体分散体,固体分散体的分类,为什么开发固体分散体,固体分散体的开发的难点以及聚合物在固体分散体开发中发挥的巨大作用,尤其是HPMCAS,今天我们不妨回归到最初的起点,谈谈单纯的API无定形态与晶态在理化性质上的差异,知其然知其所以然,更好的让我们认识ASD及其开发中的关注点和矛盾点,两者理化性质之差异如表1所示。

1.双折射现象:众所周知,无定形态和晶态是物质存在的两者固态性质。晶态物质内部存在晶格结构,分子长程有序,短程亦有序;而无定形态物质长程无序,具有较高的自由能,处于热力学不稳定状态,自发地由无定形态向晶态转变。但是无定形态不是想象中的分子就是杂乱无章的四散分布,短程存在有序现象,这样决定了无定形态和晶态存在千丝万缕的联系。下面我们不妨通过一些实例去了解无定形态与晶态在理化性质上的区别(个别例子无定形态使用ASD数据)。
大多数聚合物和药物无定形态不具有双折射而晶态药物具有双折射的现象,故而可以使用PLM偏光显微镜去识别制备成功ASD以及ASD在加速等条件下,是否发生转晶,这样PLM也成为表征ASD的一个有力的工具。
2.X射线粉末衍射图谱
X射线粉末衍射(XRPD)是对粉末样品的分析,其典型输出是强度与衍射角(2θ)的关系图。该图谱可以被认为是晶体结构的指纹,并且可用于确定样品的晶体相似性。晶态物质会出现代表特定原子平面反射的峰,对于具有相同间距的所有重复平面,将显示一个峰。相比之下,无定形态物质将呈现出宽大的驼峰。不同固态形式的乳糖的代表性XRPD图谱,如图1所示;不同固态形式的药物亦是如此,从XRPD图谱可以看出,晶型A的2q在17.2、22.3、23.2、24.6、25.2和25.8的特征峰,晶型B显示出2q的特征峰在20.7、20.9、23.8、27.2和28.1。ASD配方中化合物的无定形状态由XRPD确认, ZL006特征峰消失,如图2,图3所示。

图1 结晶无水乳糖(顶部)、结晶乳糖一水合物(中间)和无定形乳糖(底部)的XRPD图谱(引自参考文献4)
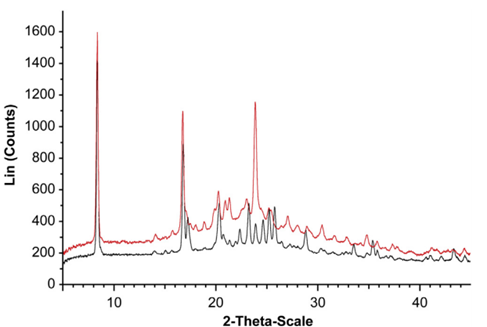
图2. ZL006 A型(黑色)和B型(红色)的XRPD图案(引自参考文献4)
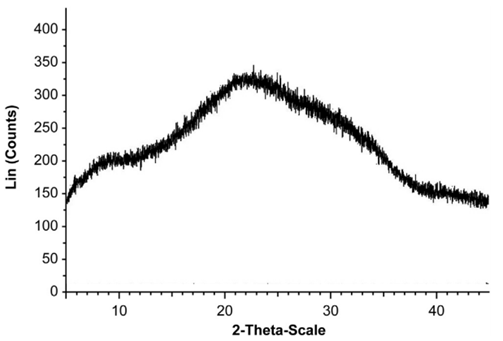
图3.ZL006固体分散体的XRPD图谱。(引自参考文献4)
3.热现象
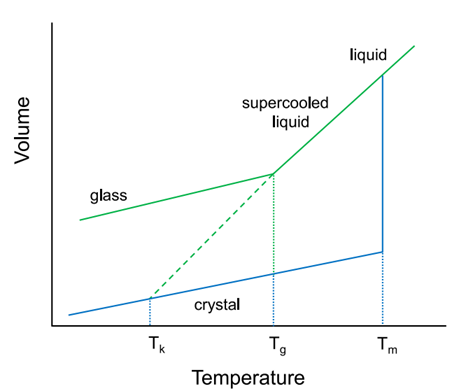
图4 固体药物无定形态的热力学相图(引自参考文献1)
图4为描述分子体积随温度降低而变化的示意图。对于一个晶态物质随着温度的升高并大于其熔点时,物质由固态转变为液态,此时的温度称之为熔点。而液态物质快速降温,转变为过冷液态和玻璃态。一般来说,过冷液态和玻璃态同为无定形态,只是在性质上有所差别,二者之间的界限,称之为玻璃化转变温度。一般大于玻璃化转变温度,分子动力学运动加剧,引起无定形的不稳定,故而一般认为无定形或者ASD的玻璃化转变温度越大越好,一般标准为75-80℃以上。(多点赞转发,下次详细介绍为什么)
4.自由能
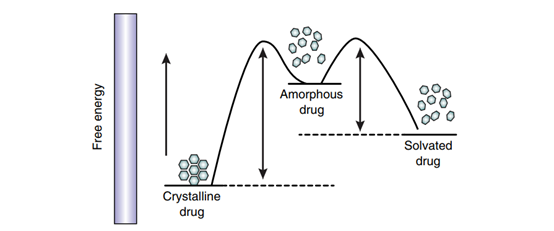
图5 理论上晶态药物,无定形态药物和溶剂化物在能量上的差异(引子参考文献6)
无定形固体通常被描述为缺乏结晶固体典型的长程平移顺序的凝聚相,尽管分子可能具有短程有序。它们在宏观尺度上表现为固体。由于缺乏长程有序,无定形态物质比晶体物质更具能量。这产生了无定形相对于结晶材料的某些优点,包括更高的比体积、更高的溶解度和生物利用度,但也带来了某些缺点,包括物理和化学稳定性较低的风险,将无定形相转化为溶解度显著降低的结晶形式会导致生物性能损失。
5.表观溶解度
根据一个晶体药物的溶解度过程:打破晶格能-溶剂形成空穴-溶质分子溶剂化。对于高熔点化合物,即晶格能较强限制晶态药物的溶解,通过药物无定形态化,可以打破晶格能,提高了药物的溶解度且大于其晶体药物的平衡溶解度,这种溶液状态称为过饱和。当然,过饱和溶液一旦越过形成晶核的能垒,就可能一步步地造成转晶的发生。
6.溶出速率
ASD的溶解度和溶出速率的瞬时增加,高能量形式的无定形固体被比作“弹簧”。ASD更高能量状态可以转化为溶解度和药物吸收的增加,但快速结晶回到更稳定和更难溶解的结晶形式会限制这种好处。抑制结晶的添加剂被描述为“降落伞”;它们在较长时间内保持过饱和。增强和延长的溶解可能导致吸收和生物利用度的进一步增加。ASD在溶出介质中的溶出现象被称之为:弹簧-降落伞,如图6所示。
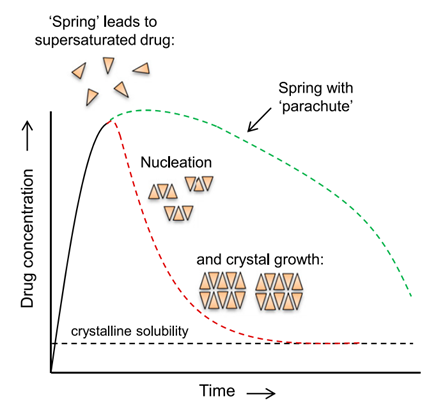
图6 图解“弹簧-降落伞”现象(引自参考文献1)
7.引湿性
晶态药物一般水分吸附在晶体的表面且量少,而水分可以进入无定形药物分子之间,水分具有抗塑性的作用,打破无定形药物与聚合物间的相互作用,增加药物分子的运动,进而引起无定形药物向晶态转变。
8.物理稳定性
图7为在室温下进行的各种固态形式的塞来昔布的X射线衍射图(a)塞来昔布的初始结晶形式;(b)通过淬火冷却制备的无定形塞来昔布;(b1-b7)在1至10天的指定时间段内观察到无定形形式变化,可以看到无定形形态逐步向晶态转变,契合了无定形药物向晶态药物转变的趋势。

图7 在室温下0-10d无定形塞来昔布的X射线衍射图(引子参考文献6)
9.化学稳定性
ASD的引入主要是增溶,带来的问题主要为转晶,即物理稳定性,但是并不说就不存在化学稳定性问题,如喷雾干燥引入有机溶剂,就需要在制备过程中考察化合物的溶液稳定性以及残留溶剂带来的稳定性问题
10.粉体学性质
喷雾干燥粉末通常表现出相对较小的颗粒,代表较大的表面积,低堆积密度,并且通常表现出较差的流动性。因此,通常需要在下游加工过程中进行预压实步骤,以将堆积密度增加到稍后允许压片或胶囊填充的水平。热熔挤出制备的ASD是致密的颗粒,具有高堆积密度,可以用粉末混合物或直接压缩来填充胶囊。有研究表明,无定形态有助于改善化合物的可压性。
总而言之,ASD在难溶性药物增溶上面可以发挥巨大的作用,但是其所有的特点也决定了其的不稳定性。有目的的区分晶态与无定形态在理化性质的差异,有助于我们去理解ASD的开发和挑战。
路漫漫其修远兮,吾将上下而求索。
参考文献:
1.Strategies to Address Low Drug Solubility in Discovery and Development
2. Solid-state analysis of the active pharmaceutical ingredient in drug products
3.晶体药物研发-理论与应用第五章药物无定形
4. Preformulation Studies and Enabling Formulation Selection for an Insoluble Compound at Preclinical Staged From In Vitro, In Silico to In Vivo
5.Pharmaceutical Amorphous Solid Dispersions by Ann Newman
6.Molecular Dynamics and Physical Stability of Amorphous Anti-Inflammatory Drug: Celecoxib
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论