
由于潜在的候选药物的水溶性低,口服生物利用度差是制药行业面临的一个日益普遍的挑战。由于溶解度低,使处于早期开发阶段的化合物的生物利用度较差,这意味着经济和治疗机会的重大损失。尽管它们可能不符合Lipinski的“五法则”,许多属于生物药剂学分类系统(BCS)的II类和IV类的低溶解度化合物,但是具有安全有效的潜力,因此,至关重要的是它们的发展并未因溶解度限制而停止,如靶向丙型肝炎病毒蛋白酶,人体免疫缺陷病毒抑制剂以及针对蛋白水解嵌合体(PROTACs)等bRo5的药物。为了解决活性药物成分(API)溶解度低的问题,已经开发了多种药物递送技术,试图溶解这些分子并提高其口服生物利用度。
增溶技术可以通过以下方式提高难溶性化合物的口服吸收:
- 1.增加药物溶解水平(即,增加溶解药物的浓度,使其高于结晶药物平衡溶解度)。
- 2.增加溶出速率。
- 3.在生理相关时间内维持肠道环境中溶解的药物浓度过饱和。
无定形固体分散体ASD通过使化合物晶体结构无定形,增加化合物的溶解度;化合物分子可以以分子的形式分散在聚合物中,表面积最大化,提高化合物的溶出速率;借助聚合物的作用,ASD溶出在胃肠道以纳米结构的形式存储药物,避免了化合物的快速转晶,维持了无定形在胃肠道吸收部门的过饱和浓度,提高药物的吸收窗,此现象称之为“弹簧-降落伞”。对于固体分散体来说,实现其以上功能需要选择合适的聚合物的辅助,而HPMCAS恰是辅助ASD功能发挥的最闪耀的一颗明珠。

图1 大连业建官网产品信息
通常HPMCAS有3种规格:L、M、H,其中L规格琥珀酰基含量最高,亲水性最强;H规格乙酰基含量最高,疏水性最强,其各规格参数如图1。HPMCAS化学结构见图2。HPMCAS具有两亲性,乙酰基疏水性基团可与难溶性药物产生疏水结合,琥珀酰基亲水性基团有利于在水性介质中形成稳定的胶束;在pH5以上环境中HPMCAS会电离,电荷有利于维持药物载体胶束的稳定,故HPMCAS能有效维持药物的过饱和浓度,抑制药物的重结晶。综上,具有独特属性的HPMCAS非常适合难溶性药物固体分散体的制备。
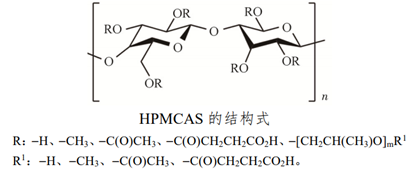
图2 HPMCAS化学结构(来源于参考2)
HPMCAS具有独特的性质,特别适合在固体分散体开发中使用,那么下面我们详细探究一番:
- (1)在未电离状态下具有高Tg。这种高Tg与药物的低迁移率直接相关,这也是HPMCAS ASD具有出色物理稳定性的原因。
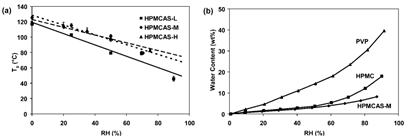
图3 RH对聚合物性能的影响:(a)HPMCAS的Tg与样品平衡(在环境温度下)和(b)HPMCAS、PVP和HPMC的平衡吸水率(在25°C下测量)。来源于参考文献3
解析:在其未电离状态,HPMCAS具有高Tg,即使暴露于高RH时也是如此。上图显示了三种市售等级HPMCAS的Tg与空气相对湿度的关系。在干燥条件下,Tg约为120°C。与所有无定形材料一样,当暴露在潮湿空气中时,HPMCAS会吸收水分,从而使聚合物塑化,从而增加其流动性。这反映在其Tg的降低上。然而,HPMCAS的相对疏水性导致对水的吸收比对典型水溶性聚合物观察到的要少得多。在75%RH下,PVP和HPMC分别吸收大约23和10wt%的水,而HPMCAS-M仅吸收大约6wt%的水。结果,HPMCAS的Tg值保持在约70°C以上,即使在使用75%RH空气平衡时也是如此,如图3所示。分散在这种高Tg玻璃状聚合物中的药物分子的低迁移率导致基于HPMCAS的ASD具有出色的物理稳定性。
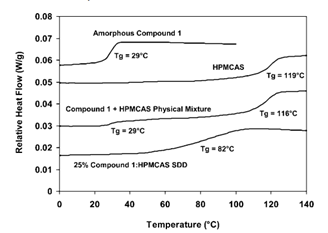
图4 单独的无定形化合物1、单独的HPMCAS、化合物1和HPMCAS的物理混合物以及25-wt%的化合物1/HPMCAS ASD的DSC数据。样品在分析前平衡在<5%RH。化合物1和HPMCAS的Tg值的单一Tg中间体的存在表明ASD是该化合物在聚合物中的均匀固溶体。来源于参考文献3
在固体分散体中制备中,最理想的状态是,API和聚合物在分子水平可混溶,形成的固体分散体是均一单相。25-wt%的化合物1/HPMCAS ASD的DSC数据现实,固体分散体Tg为82℃,表明化合物与HPMCAS形成新的相,与单独的化合物和聚合物皆不相同,如图4所示。固体分散体稳定性第一个原因来自于化合物与聚合物的相容性。
基于HPMCAS的ASD具有高稳定性的第二个原因是它们的高Tg值,这是由于聚合物的高Tg。上图显示了25wt%化合物制备的ASD的Tg非常高,远高于RH值高达约50-60%的典型存储温度。因此,药物在ASD中的迁移率(即药物在ASD中的扩散系数)。药物在处于或低于ASD的Tg的分散体中的这种低扩散速率导致药物扩散成为药物结晶的限速步骤。
- (2)易溶于丙酮、甲醇等挥发性有机溶剂,形成ASD的工艺经济可控。
解析:ASD是使用HPMCAS以非电离(质子化)形式形成的。在这种形式下,它很容易溶于挥发性有机溶剂,如甲醇和丙酮。由于许多候选药物可溶于这些溶剂中,因此可以使用喷雾干燥工艺轻松且经济地将候选药物加工成基于HPMCAS的分散体。
- (3)当至少部分电离时,如在任何高于约5的pH下,聚合物上的电荷使大聚合物聚集体的形成最小化,从而形成药物/聚合物胶体(例如,无定形纳米结构)保持稳定。
- (4)HPMCAS的两亲性质使不溶性药物分子与聚合物的疏水区域相互作用,而亲水区域使这些结构在水溶液中保持为稳定的胶体。
解析(3-4):HPMCAS包含许多非常疏水的取代基。即使当HPMCAS被电离时,如在小肠中的pH值环境中,聚合物仍然只是微溶的,并且在水溶液中以胶体聚合物聚集体的形式存在。HPMCAS离子化时的胶体性质与聚合物上取代基的疏水性质相结合,使不溶性药物分子与聚合物相互作用,导致在溶液中形成无定形药物/聚合物纳米结构。离子化的琥珀酸基团的负电荷使这些纳米结构保持稳定,避免了溶液中聚合物和药物的大疏水聚集体。这些药物/聚合物纳米结构构成了一种高能量(高溶解度)形式的无定形药物,在水性悬浮液中可稳定软化数小时,甚至数天。体外测量表明,这些纳米结构中的药物可以快速溶出到相对于结晶药物过饱和的高游离药物浓度。基于这些体外观察,相信在体内中,随着药物分配到胆盐胶束中并从肠道吸收并进入体循环,药物可以从这些纳米结构中快速溶出以取代这种药物,从而维持过饱和的游离药物浓度。这些特性最终导致在口服基于HPMCAS的ASD时观察到的吸收增强。基于HPMCAS固体分散体的溶出机制见图5,溶出各物质见图6。
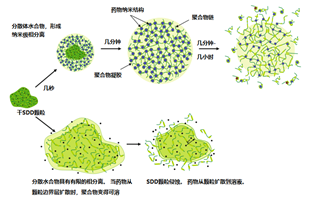
图5 两种ASD溶解机理和对体内性能至关重要的含药物物质的形成:纳米颗粒形成和侵蚀. 来源于参考文献4
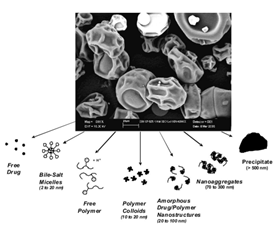
图6 为了便于表征和比较各种ASD在各种条件下形成的物质,我们根据它们的大小和组成将这些物质分为以下七类:(1)游离或溶剂化药物,(2)药物胆盐胶束,(3)游离或溶剂化聚合物,(4)聚合物胶体,(5)无定形药物/聚合物纳米结构,(6)无定形药物/聚合物纳米结构的小聚集体(称为“纳米聚集体”),和(7)大的无定形颗粒,在本文中称为沉淀物。来源于参考文献3
总而言之,HPMCASASD是提高水溶性差的药物化合物的口服生物利用度的特别有效的平台,并已成功用于具有广泛物理化学性质的候选药物。
这些ASD通过(1)快速提供远远超过其结晶溶解度的游离药物浓度和(2)长时间保持这些增强的浓度,从而显著增强低水溶性化合物的口服吸收。HPMCAS的组成和由此产生的理化性质是形成提高生物利用度的胶体结构的原因。此外,基于HPMCAS的ASD的高Tg与ASD的均质、单相无定形性质相结合,可产生物理稳定的制剂,其保质期超过在标准储存条件下2年。HPMCAS相关信息总结见下表。

1.大连业建贸易有限公司官网参考文献:
2.基于HPMCAS载体的依非韦伦固体分散体溶出模式研究
3.HydroxypropylMethylcelluloseAcetateSuccinate-BasedSpray-DriedDispersions:AnOverview
4.DesignandDevelopmentofHPMCAS-BasedSpray-DriedDispersions
5.醋酸羟丙甲纤维素琥珀酸酯在难溶性药物制剂开发中的应用进展
6.AmorphousSolidDispersions-TheoryandPractice(Chapter4ExcipientsforAmorphousSolidDispersions)
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论