
在工业生产中,多采用喷雾干燥或热熔挤出大量制备固体分散体,满足临床试验及市场需求。固体分散体以其无定形形式存在,破除了药物晶体的晶格限制,增加药物分子所处的能级,处于热力学不稳定状态,但是同时也让药物分子无序排列,具有较小的粒度,较大的表面积以及较高的润湿性,从而使得无定形药物的溶解度,与晶型药物相比,溶解度获得几倍甚至几十倍的提高,对于熔点高的化合物,尤其明显。
无定形药物因其分子的无序性而热力学不稳定,导致其有由有序向无序转变的倾向,即由热力学不稳定转变为稳定状态,也就是由稳定性转变为结晶型,就像水向低处流一样,自发进行,一往无前。纵然这个趋势无法逆转,但是我们可以控制这个逆转的时间和程度,即使制备的固体分散体制剂满足两到三年的货架期即可。因为化合物无定形化稳定性较差,往往这个时候就需要聚合物载体出场了,制备无定形固体分散体ASD。
聚合物和药物分子通过以下步骤进行制备:①通过熔化或者溶解,药物与聚合物由固体转变为液态;②然后两个组分通过搅拌、剪切,混合均匀,形成均一的真溶液或者半固体,呈现流体状态;③最后通过快速地凝结、蒸发或者冷凝等方式,迅速将上述流体转变为固体。
喷雾干燥制备固体分散体,一般原料在有机溶剂的溶解度要达到50mg/ml,因为聚合物的使用量通常在药物的2-3倍,这样就求聚合物在有机溶剂中的溶解度要求更加高,选择合适的有机溶剂将是不可忽视的关键步骤,以保证药物和聚合物完全溶解,且在喷雾干燥过程药物不会有晶体析出;而对于热熔挤出制备固体分散体,一般熔解药物温度要略高于药物的熔点但是也要保证聚合物在此温度下能保持稳定不降解,对于在低于化合物熔点也能达到完全混合或者加入表面活性剂,也可根据具体情况降低熔化温度。当然,最终的目的也是保证药物分子与聚合物高分子能完全地均匀混合,形成均一的流体,这是制备无定形固体分散体的第一步。不断的搅拌与剪切以及增加温度,皆有助于提高药物分子与聚合物的混合均一程度。以上两步,根据化合物和聚合物的理化性质,可以很好地满足,关键在于最后一步的固化速率。只有固化速度大于无定形的转晶速度,才能制备出无定形固体分散体,特别是对于喷雾干燥。喷枪雾化产生小液滴,氮气加热液滴,有机溶剂迅速的增发,产生固体颗粒,这就是我们想要制备的固体分散体,但是固体分散体在高热的氮气的作用下,提高无序分子的运动特性,这样易于由无序向有序转变,这样就和快速蒸发有机溶剂,增加固化速度相矛盾。这样就需要我们通过实验设计,合理的平衡溶剂蒸发与玻璃化转变的温度。
ASD应具有良好的物理和化学稳定性,这样才能提供增强的API溶出度和口服生物利用度。API和聚合物的单相无定形混合物可以提供最佳性能,即聚合物中药物以分子分散。分子相互作用在此类系统中起着关键作用。它们一来确保无定形药物的长期物理稳定性,二来防止药物从体内溶解时形成的过饱和溶液中沉淀。
聚合物保证固体分散体的固态稳定性的作用机制如下(来源于参考文献1):
1.制备固体分散体的高分子材料具有比较的玻璃化转变温度,如HPMSAS Tg为120℃,极大地提高所制备的ASD的Tg,一般ASD 保存在Tg-50℃以下温度,可以保证分子运动性最小,转晶的动力学降到最低。
2.聚合物与药物均匀混合,最好是分子水平混合,即形成固体溶液,药物分子以分子形式分散在聚合物中。药物分子被桎梏在聚合物材料所编制的网格中,从热力学上看,这样提高了结晶的能垒,减缓了无定形结晶化。
3.药物分子可以与聚合物通过氢键,离子键等非共价碱,发生相互作用,阻碍了药物分子的富集,从而抑制了化合物的转晶。以上一种或者多种作用的叠加,保证了ASD的固态稳定性。
无定形态的药物打破晶格能,提高了药物的溶解度且大于其晶体药物的平衡溶解度,这种溶液状态成为过饱和。药物的溶出要远远大于晶体药物的溶出,就如弹簧一样。可是,过饱和态的溶液一旦超过了结晶的能垒,溶解的药物分子便会结晶析出。无定形药物转变为亚稳定性态,然后转变为稳定型结晶,溶解度也恢复到结晶化合物的平衡溶解度。这样无定型的形成与覆灭只在顷刻之间。当使用聚合物与药物制备ASD,便可以减缓无定形向结晶态的转变,维持过饱和的时间,提高药物在体内的吸收窗,增加的药物吸收时间和进入血液循环的量,进而提高药物的生物利用度和药效。ASD的溶出快速提高与过饱和的维持提高的现象,称之为“弹簧-降落伞”现象,如下图所示。
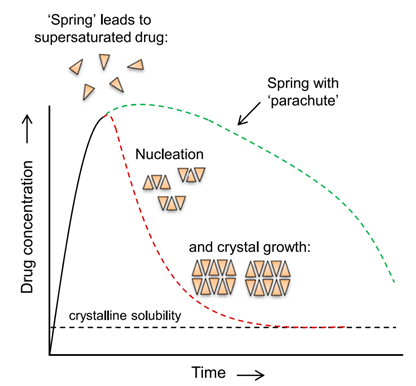
ASD在溶出介质中的“弹簧-降落伞”现象(来源于参考文献2)
那么,ASD溶液稳定性提高的作用机制如下(来源于参考文献3):
1.聚合物作为抗成核剂:聚合物可以通过与官能团的特定相互作用来抑制药物的成核和晶体生长药物。PVP、HPMC和HPMC-AS等聚合物在水溶液中的无定形稳定作用已得到广泛研究。
2.离子相互作用:与药物具有相反电荷的聚合物可以形成离子对复合物并稳定药物溶液。
3.氢键:增加氢键位点的数量会增加与药物的相互作用。伊曲康唑与HPMC的相互作用强于与PVP的相互作用。
4.溶液的粘度:高粘度会降低分子扩散和分子碰撞的速度,阻碍成核和晶体生长。
5.聚合物的分子量:高分子量聚合物与药物分子的相互作用很强。已在大分子量PVP和HPMC中观察到这种效应,它们已被证明可以长时间保持伊曲康唑的过饱和状态。这可归因于粘度增加或聚合物链中可与API相互作用的大量官能团。
6.温度:由于分子的热运动,在较高温度下,药物和聚合物之间的相互作用较弱。在25°C下非洛地平溶解期间非洛地平的浓度高于37°C,这表明较高温度下较弱的药物-聚合物相互作用可能是更快结晶的原因。
7.pH值变化:离子聚合物或药物的溶解会改变溶解介质的pH值,这会影响药物和聚合物的溶解度和沉淀行为。
8.界面张力:聚合物可以降低界面张力,防止ASD溶解时细小的药物颗粒聚集。另一方面,降低的界面张力也会增加成核并诱导药物结晶。
9.溶解聚合物的共溶剂效应:溶液中的聚合物可以作为增溶剂,增加药物的溶解度,从而降低过饱和度和药物沉淀的风险。
言而总之,单独药物分子形成无定形具有热力学不稳定且玻璃化转变温度较低,极其不稳定,易于发生转晶。通过添加聚合物,制备成固体分散体,API与聚合物相互作用,以保证ASD在固体条件下不发生晶型转变,且在溶出介质及人体胃肠道维持过饱和吸收窗,进而提高难溶性药物的溶解度,达到治病求人的效果。
参考文献:
1.晶体药物研发理论与应用:第五章药物无定形
2.Strategies to address low drug solubility in discovery and development
3.Amorphous Solid Dispersions:Theory and Practice (Chapter 5
Miniaturized ScreeningTools for Polymer and Process Evaluation)
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论