随着全球医药市场的快速发展,专利到期成为仿制药企业抢占市场份额的关键契机。本文聚焦三款即将专利到期的重磅小分子药品——TRADJENTA®(欧唐宁)、XIFAXAN®(昔服申)和SPRYCEL®(施达赛),分别从药物简介、临床应用、市场表现、专利情况以及仿制药相关动态等方面进行详细梳理,分析其国内仿制药研发格局和专利挑战现状。
一、TRADJENTA®(欧唐宁):2型糖尿病治疗的明星药物
1. TRADJENTA®药物简介及重要交易事件
TRADJENTA®(欧唐宁,通用名利格列汀片)由BoehringerIngelheim(勃林格殷格翰,BI)研发,于2011年5月在美国首次获批上市,用于治疗2型糖尿病。2013年3月26日,原研在中国获批进口,进入中国市场。
利格列汀是DPP-4抑制剂,DPP-4是一种降解肠促胰岛素激素胰高血糖素样肽1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)的酶。因此,利格列汀会增加活性肠促胰岛素激素的浓度,以葡萄糖依赖性方式刺激胰岛素的释放,并降低循环中的胰高血糖素水平。
自获批以来,BI与礼来、Yuhan、LupinLtd等多家公司达成合作,在全球范围内推广该药物。
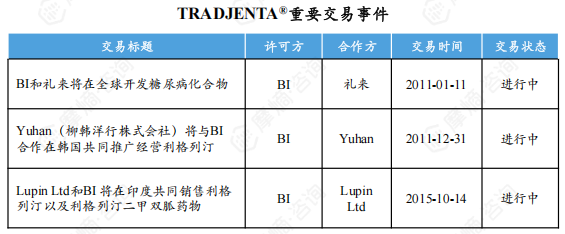
2011年1月,BI与礼来达成协议在全球合作开发包括利格列汀在内的多个糖尿病治疗药物。2011年12月,Yuhan获得了与原研公司共同在韩国经营利格列汀片的权益。2015年10月,BI与LupinLtd达成合作在印度共同推广利格列汀。
2. 利格列汀片:用于肝肾功能不全患者无需调整剂量,全球销售额近30亿美元
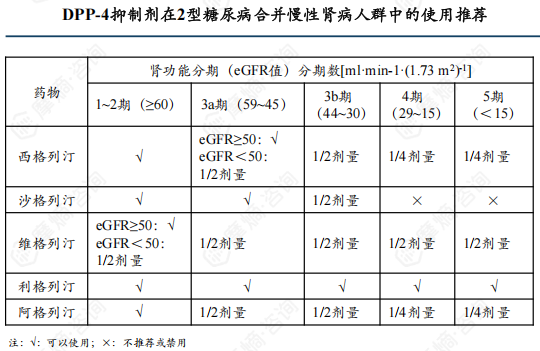
根据《中国成人2型糖尿病口服降糖药联合治疗专家共识》治疗推荐意见,利格列汀是唯一可全程用于肝、肾功能不全患者且无需调整剂量的DPP-4抑制剂。
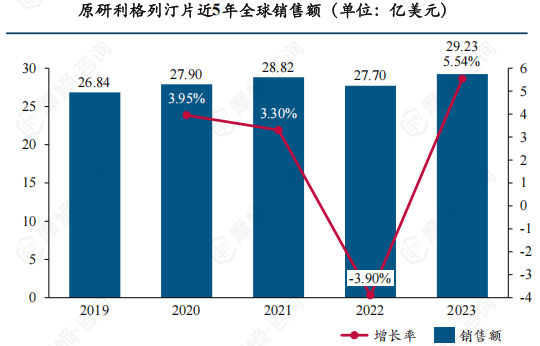
利格列汀片为每日一剂的口服DPP-4抑制剂,且无需调整剂量,集有效、安全、方便为一体,上市后迅速在临床广泛使用,2019年全球销售额已达26.84亿美元,此后两年保持缓慢增长,2022年有小幅度下跌,2023年回升且超过下降前水平,增至29.23亿美元。
数据来源:摩熵医药销售数据库
3. 利格列汀片原研专利情况及挑战历程
利格列汀片原研产品在中美的核心专利信息受到关注,东阳光等国内企业对其化合物及制剂专利提起了无效挑战。
利格列汀片原研中美核心专利信息一览
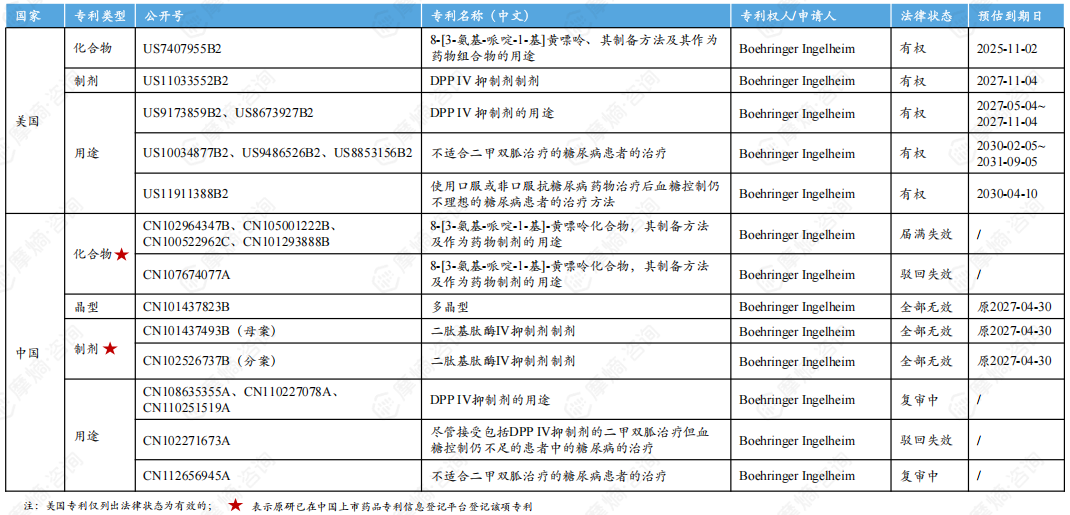
东阳光从2022年4月开始就已经开始对利格列汀片化合物专利提起了无效挑战,但未能在专利届满到期前挑战成功(届满到期日为2023年8月18日)。2018年8月28日,何明月对利格列汀片制剂专利分案提出无效请求,最终该专利宣告全部无效。
利格列汀片原研中国核心专利无效挑战历程
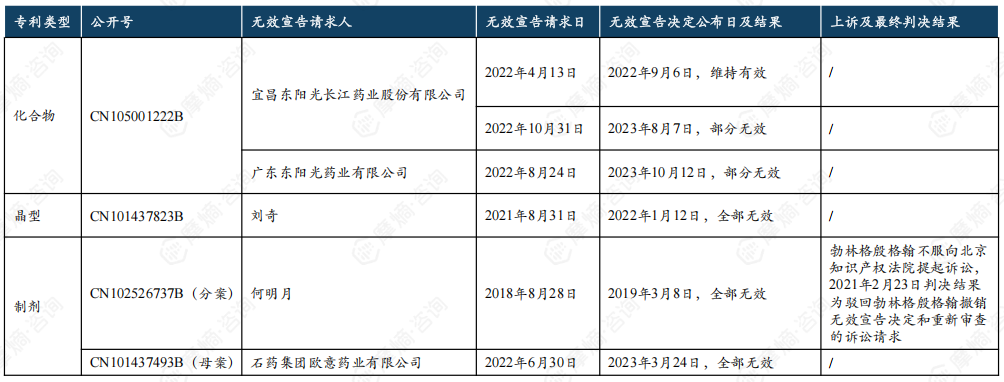
2022年6月30日,石药欧意请求无效利格列汀片制剂专利母案获得成功,2023年3月17日该专利宣告全部无效,两项制剂专利原本预计2027年4月30日到期。
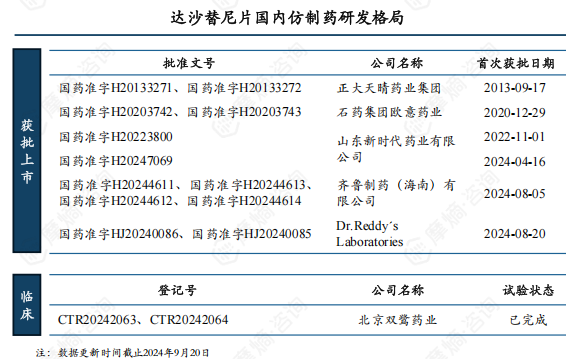
4. 2023年8月利格列汀片原研核心专利全部失效,国内仿制药市场解冻
截止2024年9月20日,国内共7家企业仿制药获批上市,其中广东东阳光为国内首仿。2020年7月8日广东东阳光仿制的利格列汀片获批上市后便开始着手挂网销售,2021年11月5日,勃林格殷格瀚就广东东阳光这一行为提出侵权诉讼,该案件被国家知识产权局列入重大专利侵权纠纷。
2022年8月5日,国家知识产权局发布了行政裁决结果,责令广东东阳光立即撤网停止销售。东阳光曾尝试无效利格列汀片化合物专利未成功,直到2023年8月利格列汀片国内核心专利到期,广东东阳光才获准恢复挂网销售资格,国内其他获批的仿制药企也陆续进入市场。
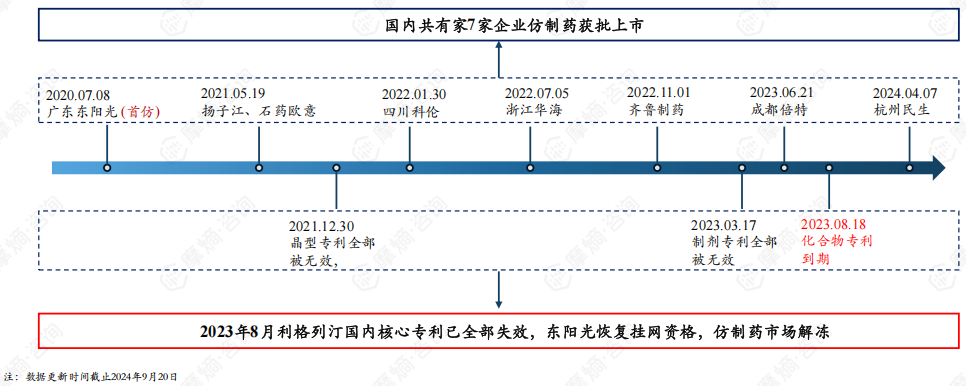
5. 竞争格局:随着仿制药涌入,利格列汀片国内市场将重新洗牌
利格列汀可谓名副其实的“明星降糖药”,近年国内市场以亿元为单位增长,2023年全年市场销售额超15亿元。
首仿企业广东东阳光在2022年遭受侵权撤网风波的情况下仍斩获了7684.74万元的市场销售额,2023年下半年广东东阳光重新恢复挂网资格开始回到市场中,并在年末总共获得了超5000万元的销售额。
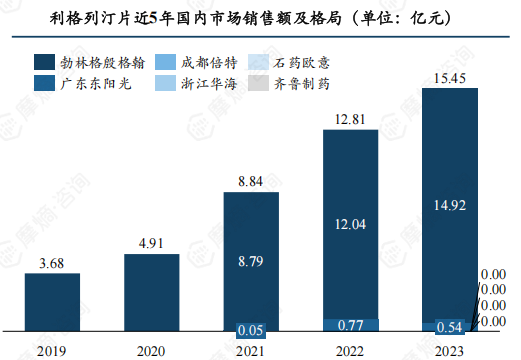
数据来源:摩熵医药销售数据库
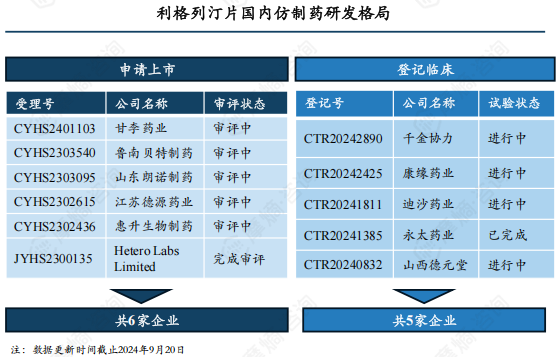
随着原研专利全部到期失效,将有更多仿制药涌入市场。截至2024年9月,除获批上市的7家外,还有6家正在申报上市(1家已完成审评),5家在开展BE试验(1家试验已完成),仿制药市场竞争俨然一幅激烈景象,进入集采之后利格列汀片国内市场格局将重新洗牌,未来市场主位花落谁家,可拭目以待。
二、XIFAXAN®(昔服申):肠道感染与肝性脑病治疗的新选择
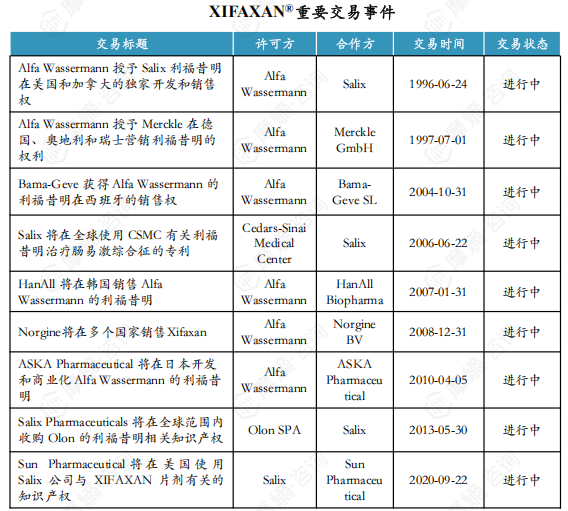
1. XIFAXAN®药物简介及重要交易事件
XIFAXAN®(昔服申,通用名利福昔明片)由Alfa Wassermann SpA(阿尔法韦士曼制药)研发,于1988年10月在意大利首次获批上市,适用于肠道感染、肝性脑病、肠易激综合征、憩室病等多种病症。
利福昔明是利福霉素类抗菌药物,能与细菌的DNA依赖性RNA多聚酶β亚基发生不可逆结合而抑制细菌RNA合成,最终抑制细菌蛋白质的合成。利福昔明具有广泛的抗菌谱,对多数革兰阳性菌和革兰阴性菌,包括需氧菌和厌氧菌具有杀菌作用。
利福昔明有5种不同的晶型(α、β、γ、δ和ε),不同晶型间的药理存在显著差异,α晶型利福昔明在胃肠道中几乎不被吸收。由于胃肠道的吸收非常低,多晶型α的利福昔明局部作用于肠腔,对侵入性致病菌无临床疗效。
图片来源:摩熵咨询《专利即将到期五大重磅小分子药品,国内仿制药“战况”几何》
2. 利福昔明临床优势:治疗肠道感染和肝性脑病获得国家权威指南认可
α晶型利福昔明口服后吸收率很低,在肠道内易形成较高的药物浓度并发挥抗菌活性,因此,对肠道感染相关疾病疗效确切。同时,其可能通过改善肠道菌群紊乱,减轻炎症反应,调节肠道免疫等机制,在一些慢性肠道炎症和肠功能紊乱的治疗中发挥作用,且对正常菌群影响较小、安全性好。
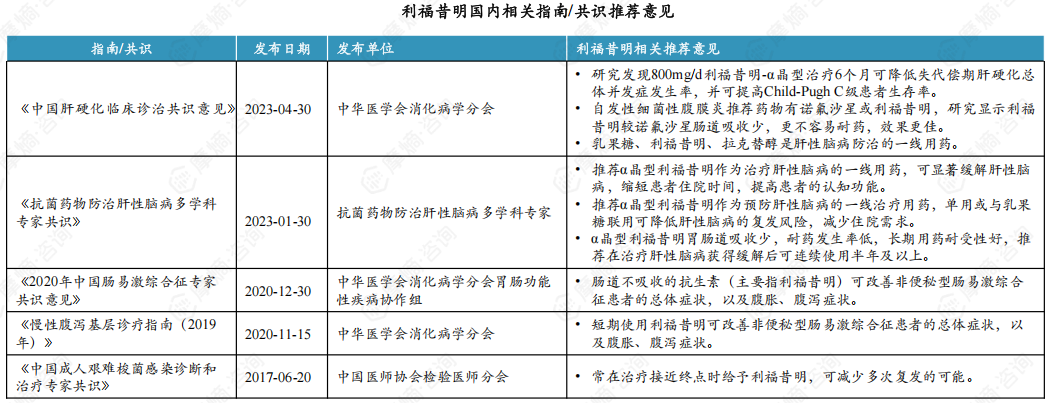
此外,利福昔明还可能通过调节肠道菌群改善内毒素血症,进而影响肠-肝轴的作用防治肝性脑病。此外还有研究发现,其对肝硬化其他并发症的防治和延长慢性肝病患者生存期均有积极作用,显示出广阔的应用前景。
3. 利福昔明片:口服不吸收广谱抗生素,疗效确切,耐受性好,前景广阔
利福昔明片是一款经典肠道抗感染药物,活性成分为α晶型利福昔明,主要用于肠道感染和高氨血症(肝性脑病)的辅助治疗,已在全球多个国家上市使用多年,积累了庞大的市场基础,近年销售额仍在稳健上升,2023年全球销售额约23.86亿美元。
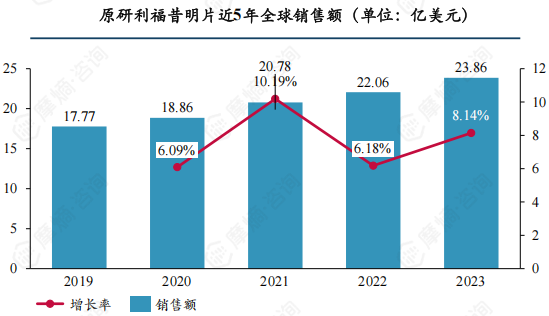
数据来源:摩熵医药销售数据库
摩熵医药全球药物研发数据库显示,利福昔明治疗克罗恩病、假性肠梗阻、镰状细胞性贫血等多种疾病的研究已进入临床阶段,目前克罗恩病在欧洲已进入III期临床,假性肠梗阻和镰状细胞性贫血分别在日本和美国开展II期临床研究。

4. 利福昔明片原研专利情况
利福昔明片的活性成分为利福昔明α晶型,原研α晶型在中国的专利权将于2024年11月4日到期。除α晶型外,原研还布局了β、γ、δ和ε晶型的专利,其中β和γ晶型专利将与α晶型一同到期,δ和ε晶型专利将于2025年7月20日到期。但原研并未在中国上市药品专利信息登记平台登记相关专利信息。
利福昔明片原研中美核心专利信息一览
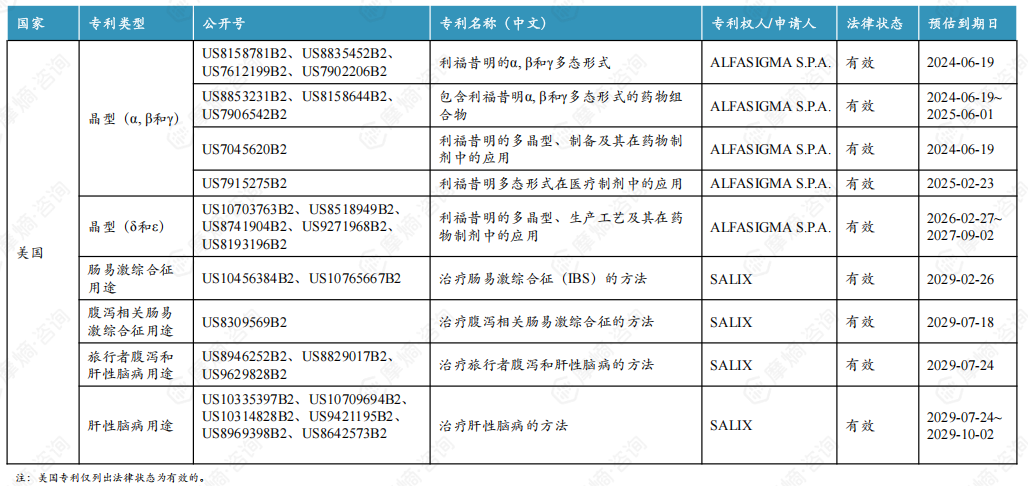
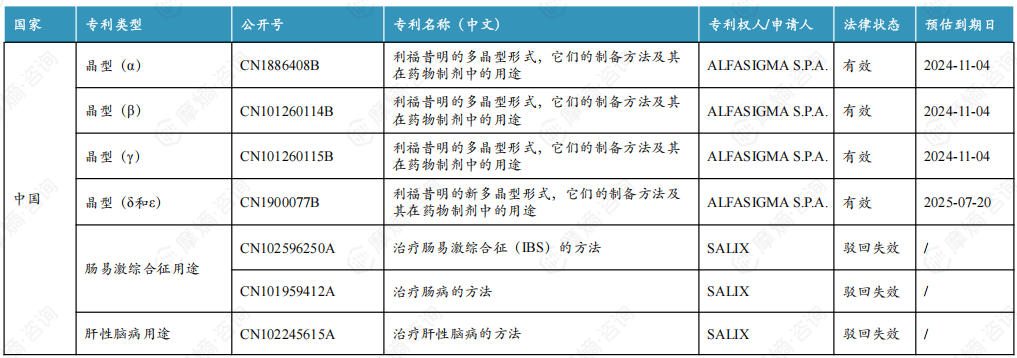
原研曾计划在国内布局肠易激综合征和肝性脑病用途专利,但均以被国家知识产权局驳回失效告终。
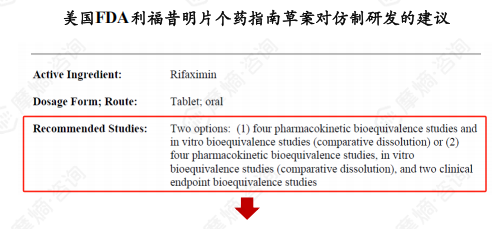
5. 仿制药市场:核心晶型专利届满日在即,但临床难度令仿制药企望而却步
事实上,国内已有利福昔明仿制药上市并应用多年,但都是未通过一致性评价的老批文,获批剂型包括片剂、干混悬剂、胶囊剂。据摩熵医药销售数据库显示,近年胶囊剂已退出市场,目前主要应用剂型为片剂,干混悬剂在市场中也还占有一席之地。
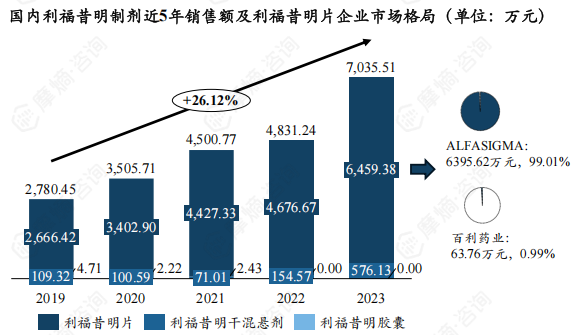
国内利福昔明制剂市场向好,5年市场增速为26.13%,2023年市场增量更是超2000万元,销售额达7035.51万元,其中有6459.38万元来自利福昔明片。
目前国内利福昔明片市场几乎全部落入原研囊中,仿制药市场占比不到1%。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论