本研究报告旨在对专利即将到期的五款重磅药品的国内仿制药研发格局和专利挑战现状进行盘点和分析,总结相关药品专利的攻防策略,洞察药品专利链接制度对药品专利保护及仿制药研发的意义和影响。
一、中国药品专利链接制度解读
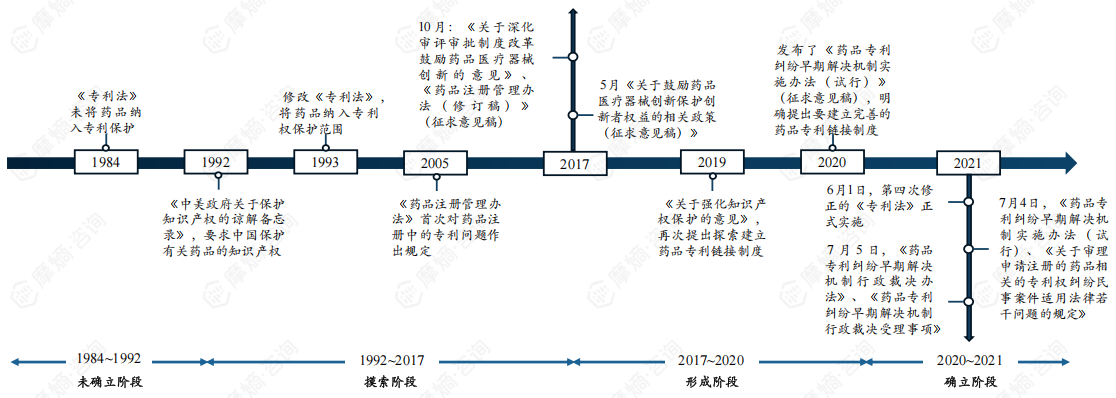
1. 中国药品专利链接制度不断发展完善,为中国药品发展保驾护航
药品专利链接制度是指将药品上市审批程序与药品专利纠纷解决程序相衔接的制度,中国的药品专利链接制度的演进大致经历了摸索、形成与确立三个阶段。2021年7月,随着中国药品专利链接制度的具体实施办法相继公布,药品专利链接制度的内容也随之确定。
专利链接制度的建立将药品专利纠纷提前,增加了仿制药企业与原研企业在药品专利信息方面的透明度,既能让原研企业提前获知专利被挑战的消息从而作出及时维权的举措,又能让仿制药企业提前了解原研核心专利,省去获取核心专利的检索成本,并提早研究专利规避策略。总之,药品专利链接制度有利于原研药与仿制药的利益平衡,为中国药品的发展保驾护航。
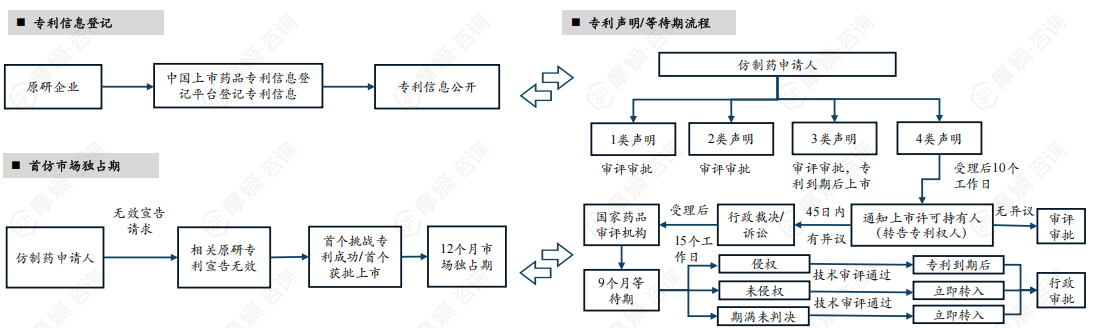
2. 中国药品专利链接主要内容:专利信息登记、专利声明、等待期、首仿市场独占期
药品专利信息登记制度允许登记三种类型的药品,即中药、化学药和生物制品,登记的平台为中国上市药品专利信息登记平台(下称药品专利信息登记平台)。
中国的专利声明包括四种类型:
1类:药品专利信息登记平台中没有被仿制药品相关专利信息;
2类:药品专利信息登记平台收录的被仿制药品相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可;
3类:药品专利信息登记平台收录有被仿制药品相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;
4.1类:药品专利信息登记平台收录的被仿制药品相关专利权应当被宣告无效;
4.2类:仿制药未落入药品专利信息登记平台收录的被仿制药品相关专利权的保护范围。
中国的等待期制度只针对化学仿制药,等待期为9个月。等待期的触发条件为专利权人或者利害关系人(以下合称权利人)对第四类专利声明有异议的向法院起诉或请求行政裁决。等待期自人民法院立案或者国务院专利行政部门受理之日起算,且只设置一次,等待期内国家药品审评机构不停止技术审评。
只有化学仿制药可以适用中国的首仿药独占期制度,首仿药市场独占期为12个月。另外,首仿药市场独占期不得超过被挑战药品的原专利权期限,且市场独占期内国家药品审评机构不停止技术审评。
二、专利即将到期五款重磅小分子药品筛选
从2025年美国专利即将到期的药品中挖掘中国专利临期的重磅品种。
在摩熵数据-全球上市药品专利数据库中检索2025年美国专利即将到期的药品,限定搜索条件为:数据来源“美国橙皮书”+预估到期日“2025-01-01至2025-12-31”+法律状态“有权”,共得到473条结果数据,其中包括216个药品品种,即共有216个药品部分美国专利将于2025年到期。
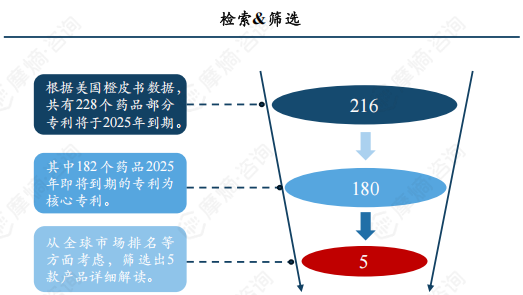
进一步判断筛选,216个药品中有180个即将到期的部分专利为核心专利(化合物、晶型、组合物、用途),最后从全球市场销售额排名、中国核心专利届满到期日(5年以内,不考虑无效的情况)方面综合考虑,挑选出五款重磅产品进行专利及国内仿制格局解读, 五款重磅产品分别为:ENTRESTO® (沙库巴曲缬沙坦钠片)、TRELEGY ELLIPTA® (氟替美维吸入粉雾剂)、 TRADJENTA® (利格列汀片) 、XIFAXAN® (利福昔明片)、 SPRYCEL® (达沙替尼片)。

三、专利即将到期五款重磅小分子药品盘点
(一)ENTRESTO®
1. ENTRESTO®药物简介及重要交易事件
商品名:ENTRESTO® (诺欣妥)
通用名:沙库巴曲缬沙坦钠片
活性成分:沙库巴曲+缬沙坦三钠半五水合物
首次获批时间:2015-07-07(美国)
原研企业:Novartis(诺华)
适应症:心力衰竭;原发性高血压
作用机制:沙库巴曲缬沙坦钠片含有脑啡肽酶抑制剂沙库巴曲和血管紧张素受体阻滞剂缬沙坦,可通过 LBQ657(前体药物沙库巴曲的活性代谢物)抑制脑啡肽酶(中性内肽酶;NEP),并通过缬沙坦阻断血管紧张素 II 1 型 (AT ) 受体。
沙库巴曲缬沙坦钠片由Novartis AG (诺华)研发,2015年7月首次获FDA批准上市。2017年7月26原研在中国获批进口,进入中国市场。
重要交易事件:
- 2016年11月,诺华将其在西班牙的分销权授予Laboratorios Farmaceuticos Rovi SA。
- 2020年2月,诺华与日本大冢制药达成商业化许可协议,原研沙库巴曲缬沙坦钠片在日本的原研代理公司为日本大冢制药。
- 2022年4月,Dr Reddy‘s Laboratories从诺华处购买获得原研沙库巴曲缬沙坦钠片在印度的商业权益。
2. 沙库巴曲缬沙坦钠——心衰和原发性高血压治疗药物
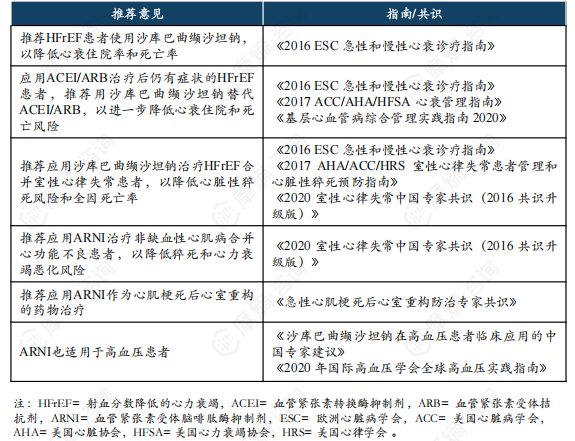
沙库巴曲缬沙坦钠,是国内外多个指南一致推荐的心衰和原发性高血压治疗药物。
基于临床研究结果,2016年欧洲心脏病学会和2017年美国心脏病学会/美国心脏协会分别更新了心衰指南,将沙库巴曲缬沙坦钠作为HFrEF的Ⅰ类推荐;《中国心力衰竭诊断和治疗指南 2018》、《慢性心力衰竭基层诊疗指南(2019年)》和《基层心血管病综合管理实践指南 2020》均对ARNI在HFrEF患者中的应用进行了明确推荐。
2021年1月,美国心脏病学会更新了优化心衰治疗的专家共识,建议HFrEF患者在不使用ACEI/ARB预处理的情况下,可优先使用沙库巴曲缬沙坦钠。
2021年2月,FDA批准了沙库巴曲缬沙坦钠扩大适应证的申请,批准该药用于降低成年人慢性心衰患者的心血管死亡和心衰住院风险,其中包括HFpEF患者。
在高血压治疗领域,2020年国际高血压学会发布的全球高血压实践指南中指出,沙库巴曲缬沙坦钠也适用于高血压人群。2021年2月发表的《沙库巴曲缬沙坦钠在高血压患者中临床应用中国专家建议》建议将沙库巴曲缬沙坦钠用于原发性高血压病患者的降压治疗,尤其是老年高血压、盐敏感性高血压、高血压合并心衰、高血压合并左心室肥厚、高血压合并慢性肾脏病(1~3期)和高血压合并肥胖的患者。
3. 充分的循证证据支持沙库巴曲缬沙坦钠的降血压效果以及靶器官保护作用
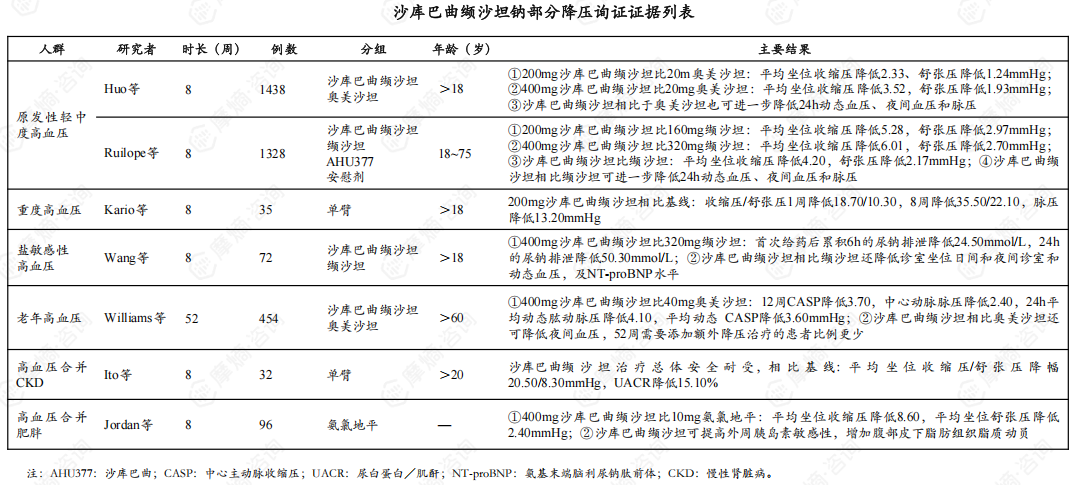
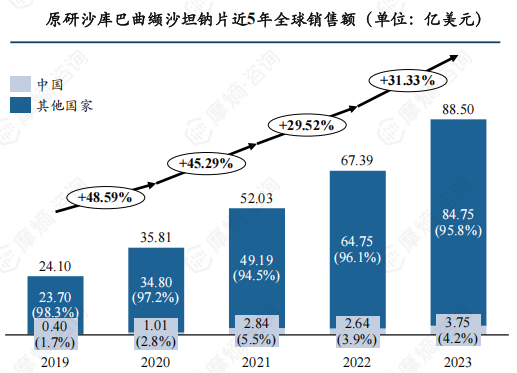
4. 沙库巴曲缬沙坦钠片:心血管领域突破性创新药,原研产品全球销售额近90亿美元
作为全球首款心血管治疗领域的突破性创新药,近年来原研沙库巴曲缬沙坦钠片全球市场销售额高速增长,2023年达88.5亿美元,国内市场整体也呈上升趋势,2023年总销售额超3亿美元,但在全球市场中占比较小,约4.2%。
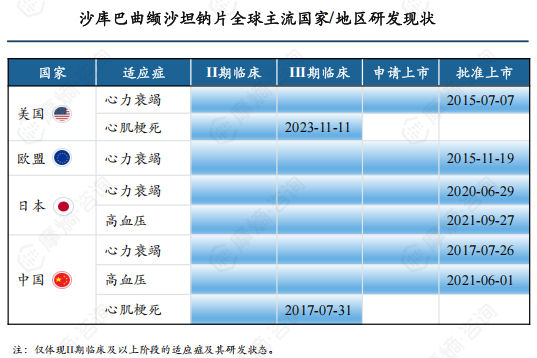
沙库巴曲缬沙坦钠已获批的适应症包括心力衰竭、原发性高血压和高血压病,其中心力衰竭在中、美、日、欧均已获批,高血压在中国和日本已获批。
除已获批的适应症外,沙库巴曲缬沙坦钠还有其他心血管疾病领域适应症在研发中,其中心肌梗死在中国和美国已进入III期临床阶段,中国的III期临床试验已完成。
5. 沙库巴曲缬沙坦钠片原研中美核心专利信息一览
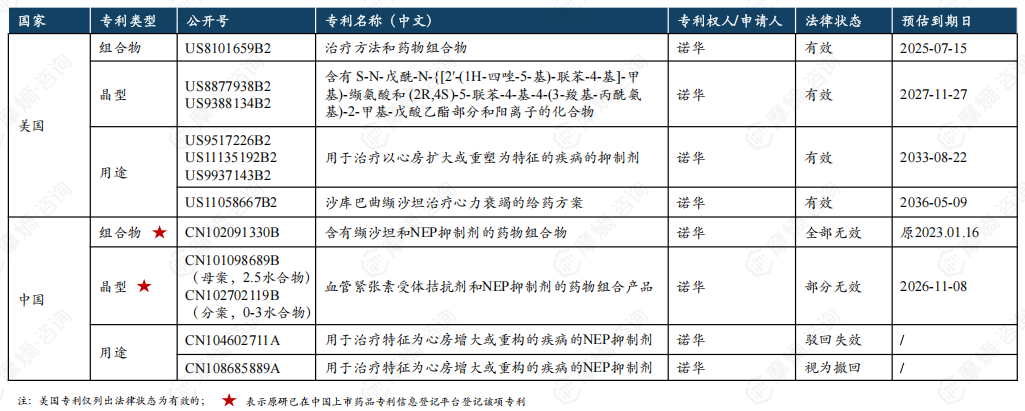
原研沙库巴曲缬沙坦钠片在中国的核心专利包括组合物专利( 公开号CN102091330B)和晶型专利(公开号CN101098689B(母案)CN102702119B(分案)),组合物专利早在2018年1月已宣告全部无效,晶型专利部分无效,有效部分预计2026年11月8日到期。
6. 沙库巴曲缬沙坦钠片原研中国核心专利无效挑战历程
沙库巴曲缬沙坦钠片原研化合物/组合物专利2018年1月3日被宣告全部无效,此后诺华不服先后上诉至北京知识产权法院和最高人民法院,最终2021年6月30日二审判决维持原判全部无效的结果。
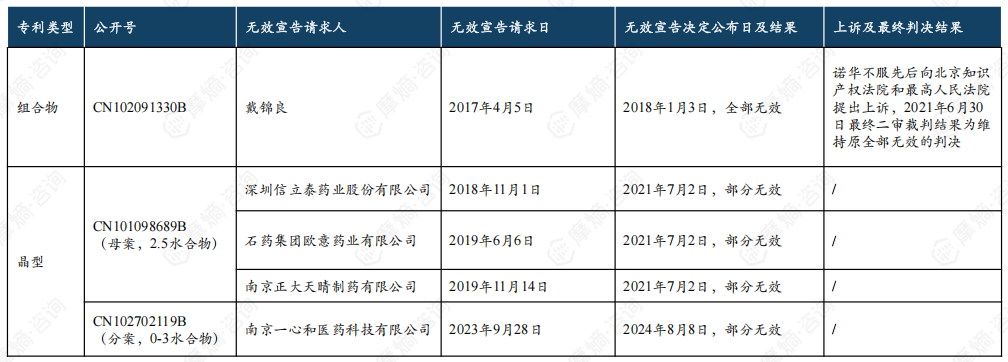
沙库巴曲缬沙坦钠片原研2.5水合物晶型专利接连遭受深圳信立泰药业、石药集团欧意药业和南京正大天晴制药的无效挑战,2021年7月2日被宣告部分无效。
据悉,南京一心和医药自主研发出了沙库巴曲缬沙坦钠新晶型,该晶型为3水合物,已做到与原研2.5水合物等效,考虑到可能仍有侵权风险,2023年9月28日,南京一心和医药对原研0-3水合物晶型专利发起了无效挑战,2024年8月8日该专利被宣告部分无效,2024年9月3日无效宣告结案。
7. 原研公司诺华已申请晶型专利期限补偿, 沙库巴曲缬沙坦钠片专利有可能延期
沙库巴曲缬沙坦钠片原研晶型专利经历诸多无效挑战至今未能被全部无效,有效部分原本预计2026年11月8日到期,但诺华已提交专利期限补偿请求,目前已进入审查,释放出专利保护期可能延长的信号。

8. 专利挑战与仿制研发热潮兴起,原研公司诺华采取和解的方式维护专利权益
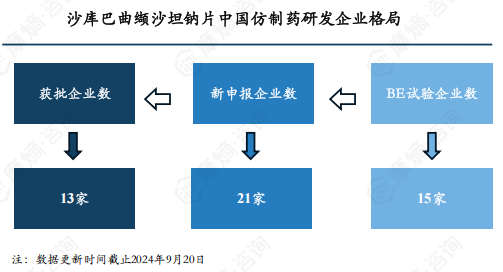
沙库巴曲缬沙坦钠片的问世在心血管领域开辟了一片新的蓝海,众多仿制企业对这块“肥肉”虎视眈眈,开始着手研发仿制药品,实力雄厚的企业纷纷对原研专利发起无效挑战,意图抢占首仿地位,其他众多企业也趁势入局,引发了仿制热潮。截至2024年9月20日,已有13家仿制药企业获得批文,21家企业正在申报注册中,另外还有15家企业正在开展BE试验。
经统计,目前已获得仿制药批文的13家企业中有4家对原研晶型专利明确登记了3类声明,有1家(浙江昂利康制药)登记了4.2类,1家(江苏华瀚医药)登记了2类,有7家企业未登记。值得注意的是江苏华瀚获得了原研专利实施许可,可实现提前上市销售;正大天晴获得原研0-3水合物晶型专利实施许可,但推测仍需等待2.5水合物晶型专利过期后才能上市销售。申报注册的21家企业中20家登记了3类声明,1家(江苏利泰尔药业)登记了4.2类声明,经查询,江苏利泰尔药业与自主研发新晶型的南京一心和医药同属方生和医药的子公司。
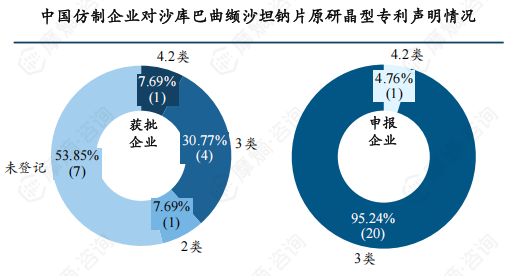
由上述信息可知,面对仿制药企的专利挑战和仿制热潮,诺华与部分仿制药企达成和解协议,以避免专利悬崖,维持专利权益,降低市场损失。
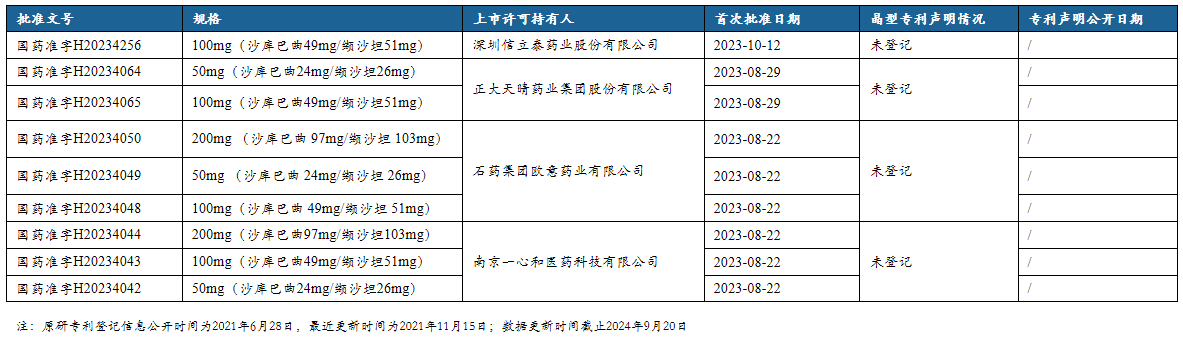
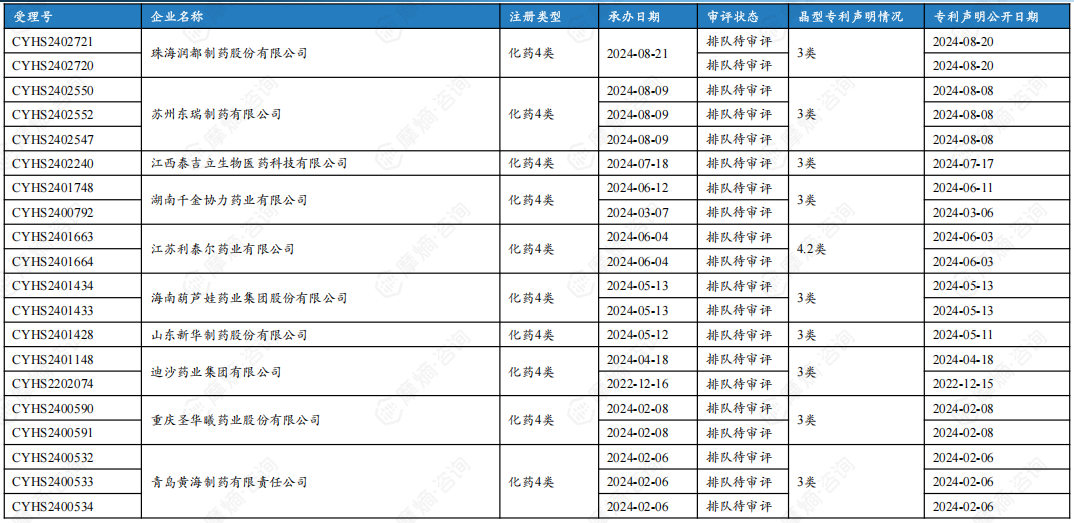
9. 沙库巴曲缬沙坦钠片仿制药中国批准文详情

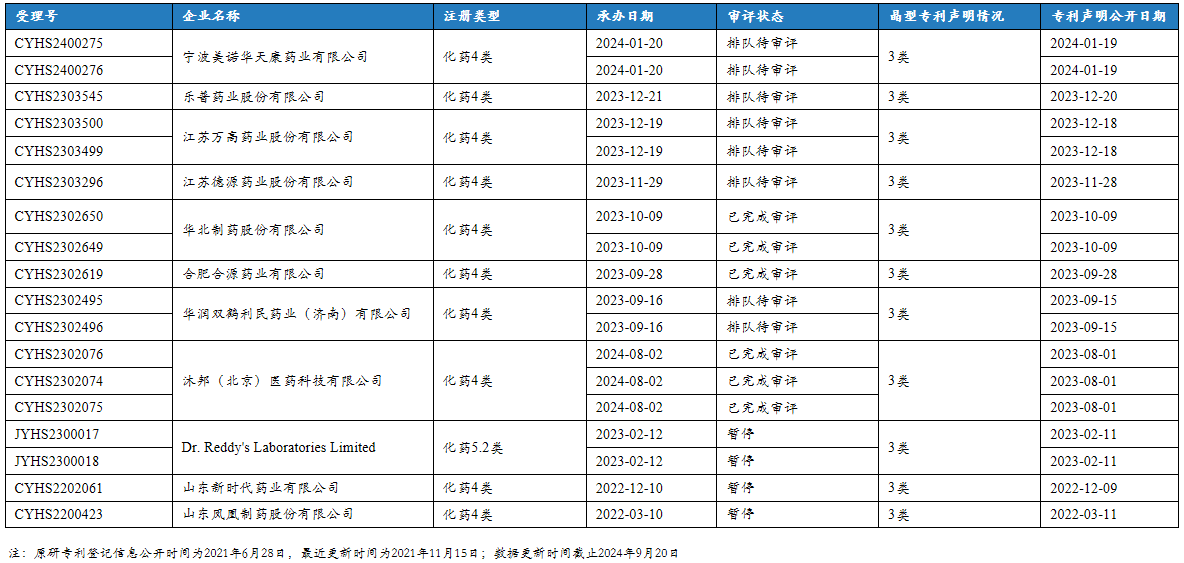
10. 沙库巴曲缬沙坦钠片中国新申报注册详情
(二)TRELEGY ELLIPTA®
1. TRELEGY ELLIPTA® 药物简介及重要交易事件
商品名:TRELEGY ELLIPTA® (全再乐)
通用名:氟替美维吸入粉雾剂
活性成分:糠酸氟替卡松+乌美溴铵+三苯乙酸维兰特罗
首次获批时间:2017-09-18(美国)
原研企业:GSK(葛兰素史克)
适应症:哮喘、慢性阻塞性肺疾病(COPD)
作用机制:氟替美维吸入粉雾剂由糠酸氟替卡松、乌美溴铵和三苯乙酸维兰特罗三个活性成分组成的复方制剂,糠酸氟替卡松是一种合成三氟化皮质类固醇,具有抗炎活性;乌美溴铵是一种长效毒蕈碱拮抗剂,具有支气管扩张作用;维兰特罗是一种长效肾上腺素受体激动剂,具有松弛支气管平滑肌作用。
氟替美维吸入粉雾剂由GSK研发,2017年9月首次在美国获批上市,首次获批适应症为(COPD),2020年9月,哮喘适应症获FDA批准。2019年11月4日原研在中国获批进口。
重要交易事件:
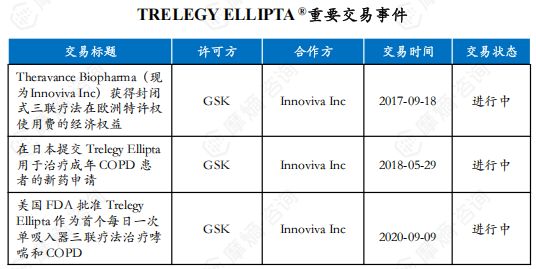
2002 年 11 月,Theravance(现为Innoviva Inc)与GSK结成联盟,开发用于治疗呼吸系统疾病的长效 β-2 激动剂 (LABA),从此开始了长期合作。2017 年 9 月,Theravance 获得 GSK 封闭式三联疗法(氟替美维吸入粉雾剂)在欧洲的经济权益。2018 年 5 月,双方进一步宣布向日本厚生劳动省 (MHLW) 提交了氟替美维吸入粉雾剂用于治疗成年COPD患者的新药申请。 2020年9月,双方合作开发的哮喘新适应症获美国FDA批准,并宣称氟替美维吸入粉雾剂为首个每日一次的单吸入器三联疗法制剂用于治疗哮喘和COPD。
2. 氟替美维吸入粉雾剂与上一代二联疗法相比临床优势显著
与氟替卡松糠酸酯/维兰特罗和乌美溴铵/维兰特罗相比,氟替美维吸入粉雾剂治疗显示肺功能显著改善。第 52 周,氟替美维吸入粉雾剂与氟替卡松糠酸酯/维兰特罗相比,FEV 1谷值(给药前)与基线相比的平均变化为 97 mL(95% CI:85, 109;P <0.001),氟替美维吸入粉雾剂与乌美溴铵/维兰特罗相比,FEV 1谷值与基线相比的平均变化为 54 mL(95% CI:39, 69;P <0.001)。

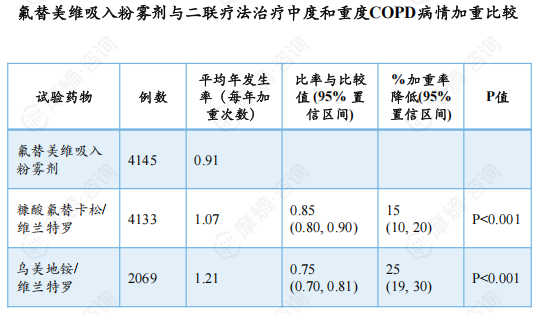
一项试验分别比较了氟替美维吸入粉雾剂与糠酸氟替卡松/维兰特罗和乌美溴铵/维兰特罗二联疗法治疗中度和中度COPD的病情加重情况,试验主要终点为平均年加重发生率。结果显示,与糠酸氟替卡松/维兰特罗相比,使用氟替美维吸入粉雾剂治疗年加重发生率可显著降低15%;与乌美溴铵/维兰特罗相比,可显著降低 25%。
3. 氟替美维吸入粉雾剂:新一代COPD和哮喘三联疗法,原研产品全球销售额超60亿美元
氟替美维吸入粉雾剂是FDA批准的首款治疗COPD和哮喘的每日一次单吸入器三联疗法制剂,与上一代二联疗法(糠酸氟替卡松/维兰特罗、乌美溴铵/维兰特罗)相比可显著改善COPD患者肺功能,缓解症状和急性加重,降低死亡率。得益于其显著的临床优势,近年来原研氟替美维吸入粉雾剂全球销售额节节攀升,增速有放缓趋势,截至2023年末全球销售额达64.51亿美元,中国市场销售额约0.37亿美元,仅占全球市场的0.57%。
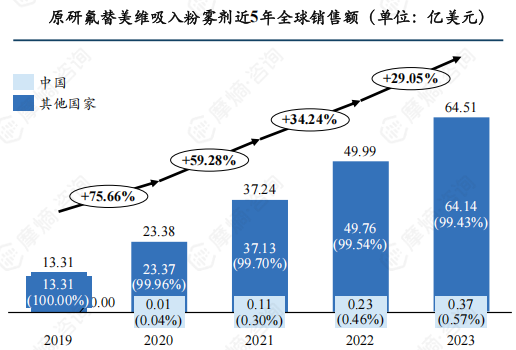
氟替美维吸入粉雾剂目前仅用于治疗COPD和哮喘,未开发其他新适应症。COPD 适应症在全球主流国家/地区均已获批,哮喘适应症在美国、日本已获批,但在欧盟申请扩哮喘适应症未被批准,理由是欧洲药品管理局认为原研公司提供的临床证据不足以证明其对哮喘的疗效。哮喘适应症在中国还处于III期临床阶段。

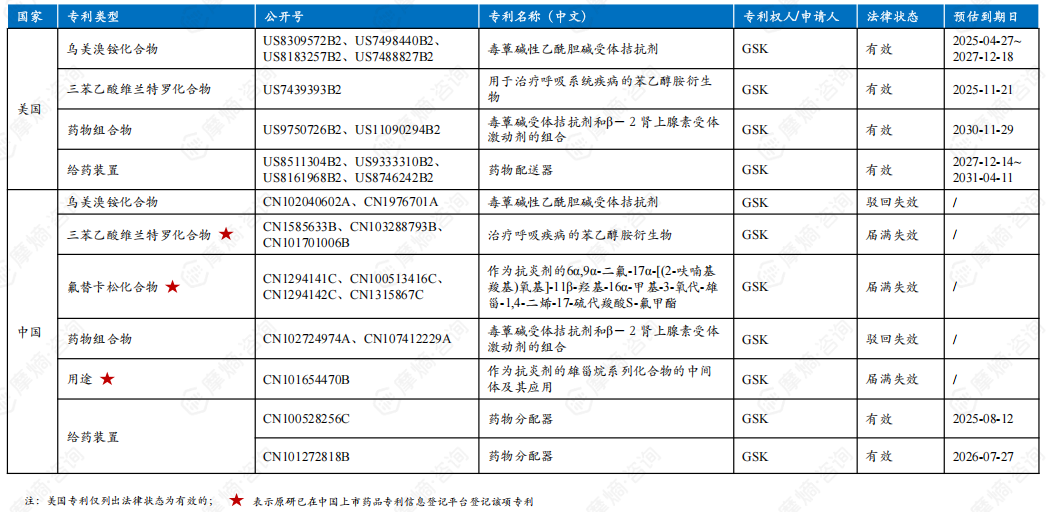
4. 氟替美维吸入粉雾剂原研中美核心专利信息一览
5. 国内吸入药物药械一体化领先企业正大天晴或将成为氟替美维吸入粉雾剂仿制头马
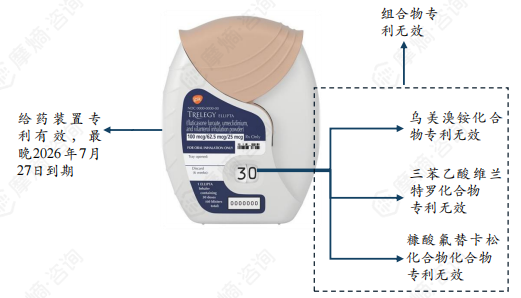
根据原研说明书描述,氟替美维吸入粉雾剂为药械一体化产品。经专利查询分析后发现氟替美维吸入粉雾剂3种活性成分化合物专利以及3种成分的药物组合物专利在中国均已处于无效状态,给药装置专利权预计2026年7月27日届满失效,专利保护期已不足两年,但原研在专利信息登记平台登记的专利信息不包含给药装置专利。
目前国内暂无仿制药研发信息,推测原因可能一方面是药械一体化吸入制剂研发难度较大,另一方面是参比制剂2024年8月28日刚正式公布。
正大天晴是国内吸入药物药械一体化设计与制造、哮喘精准诊断药物领域领先企业,突破了国内 COPD 治疗药物及器具方面的关键技术瓶颈,公司已有多款吸入制剂产品获批上市,同时也在跟进研发新产品,在哮喘、慢阻肺、尘肺、慢性咳喘等适应症全面发力,不断完善呼吸系统疾病领域布局。
正大天晴已跟进研发COPD/哮喘二联疗法——糠酸氟替卡松维兰特罗吸入粉雾剂和乌美溴铵维兰特罗吸入粉雾剂多年,目前两款药物处于BE试验阶段。由于具有一定的研发基础,推测正大天晴有望成功突破氟替美维吸入粉雾剂(氟替美维吸入粉雾剂)的给药装置专利壁垒,成为新一代三联疗法的仿制头马。

(三)TRADJENTA®
1. TRADJENTA® 药物简介及重要交易事件
商品名:TRADJENTA® (欧唐宁)
通用名:利格列汀片
活性成分:利格列汀
首次获批时间:2011-05-02(美国)
原研企业:Boehringer Ingelheim (勃林格殷格翰,BI)
适应症:2型糖尿病
作用机制:利格列汀是 DPP-4 的抑制剂,DPP-4 是一种降解肠促胰岛素激素胰高血糖素样肽 1 (GLP-1) 和葡萄糖依赖性促胰岛素多肽 (GIP) 的酶。因此,利格列汀会增加活性肠促胰岛素激素的浓度,以葡萄糖依赖性方式刺激胰岛素的释放,并降低循环中的胰高血糖素水平。
利格列汀片由BI研发,2011年5月首次在美国获批上市,用于治疗2型糖尿病。2013年3月26日,原研在中国获批进口,进入中国市场。
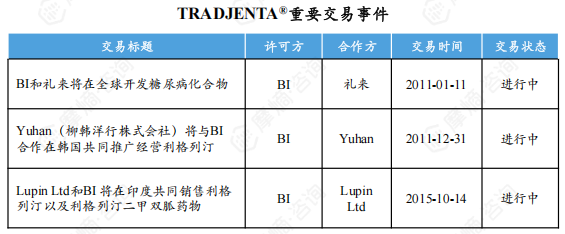
2011年1月, BI与礼来达成协议在全球合作开发包括利格列汀在内的多个糖尿病治疗药物。利格列汀片获批上市后不久的2011年12月,Yuhan获得了与原研公司共同在韩国经营利格列汀片的权益。2015年10月, BI与Lupin Ltd达成合作在印度共同推广利格列汀。
2. 利格列汀片用于肝肾功能不全患者无需调整剂量,原研产品全球销售额近30亿美元
根据《中国成人2型糖尿病口服降糖药联合治疗专家共识》治疗推荐意见,利格列汀是唯一可全程用于肝、肾功能不全患者且无需调整剂量的DPP-4抑制剂。
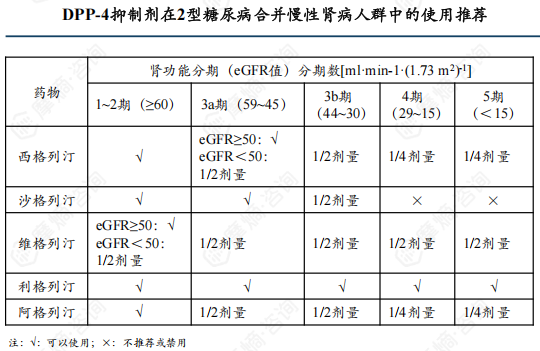
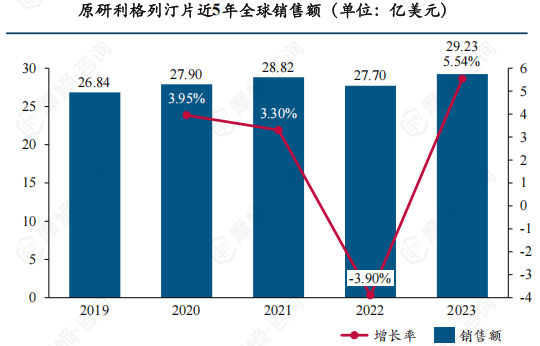
利格列汀片为每日一剂的口服DPP-4抑制剂,且无需调整剂量,集有效、安全、方便为一体,上市后迅速在临床广泛使用,2019年全球销售额已达26.84亿美元,此后两年保持缓慢增长,2022年有小幅度下跌,2023年回升且超过下降前水平,增至29.23亿美元。
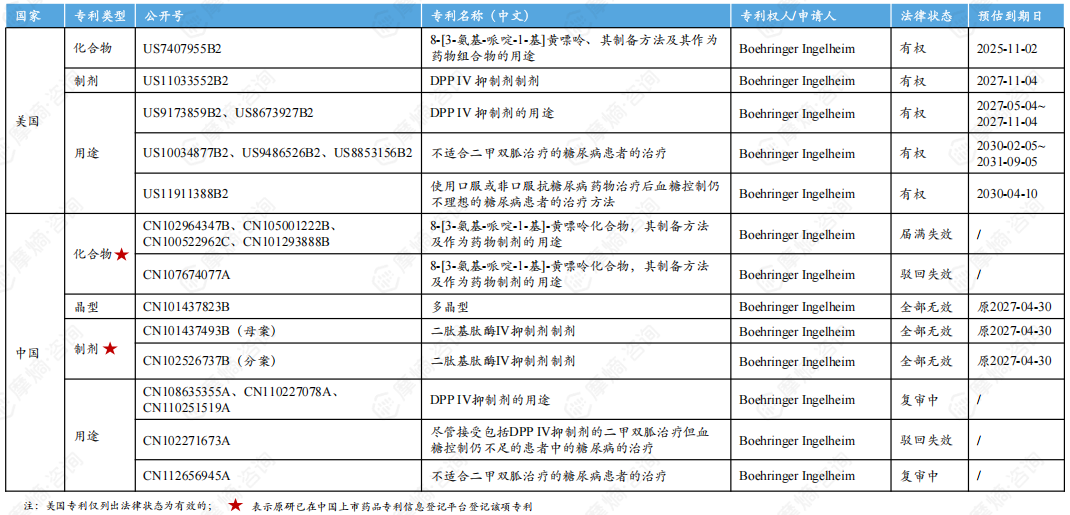
3. 利格列汀片原研中美核心专利信息一览
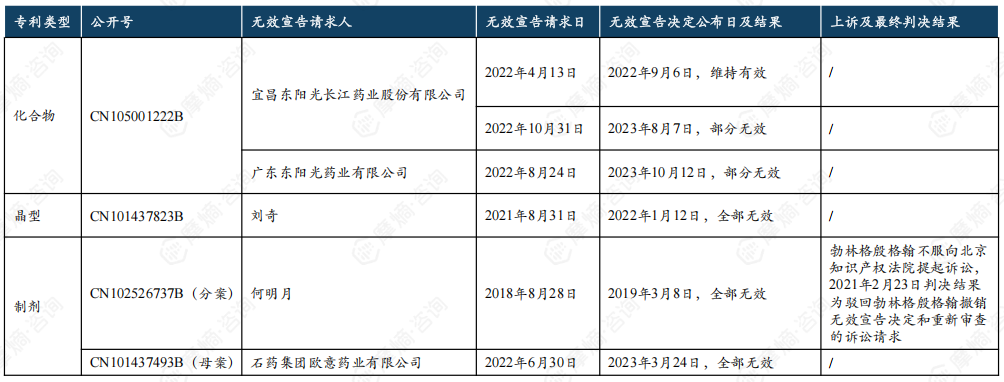
4. 利格列汀片原研中国核心专利无效挑战历程
东阳光从2022年4月开始就已经开始对利格列汀片化合物专利提起了无效挑战,但未能在专利届满到期前挑战成功(届满到期日为2023年8月18日)。2018年8月28日,何明月对利格列汀片制剂专利分案提出无效请求,最终该专利宣告全部无效。2022年6月30日,石药欧意请求无效利格列汀片制剂专利母案获得成功,2023年3月17日该专利宣告全部无效,两项制剂专利原本预计2027年4月30日到期。
5. 2023年8月利格列汀片原研核心专利全部失效,国内仿制药市场解冻
截至2024年9月20日,国内共7家企业仿制药获批上市,其中广东东阳光为国内首仿。2020年7月8日广东东阳光仿制的利格列汀片获批上市后便开始着手挂网销售,2021年11月5日,勃林格殷格瀚就广东东阳光这一行为提出侵权诉讼,该案件被国家知识产权局列入重大专利侵权纠纷,2022年8月5日,国家知识产权局发布了行政裁决结果,责令广东东阳光立即撤网停止销售。东阳光曾尝试无效利格列汀片化合物专利未成功,直到2023年8月利格列汀片国内核心专利到期,广东东阳光才获准恢复挂网销售资格,国内其他获批的仿制药企也陆续进入市场。
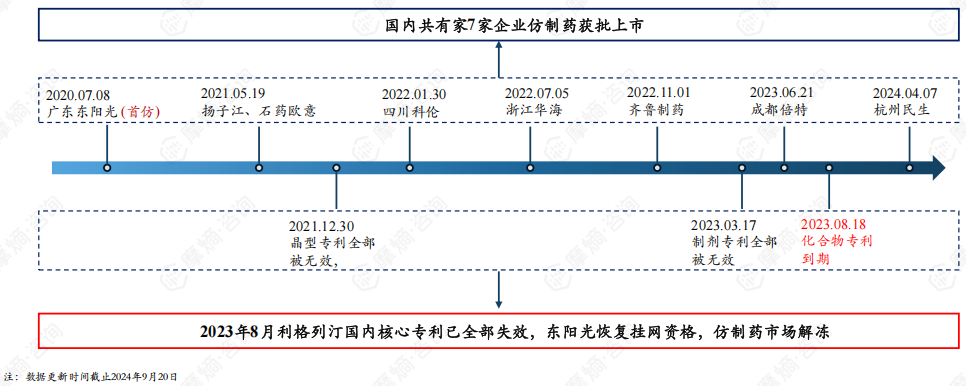
6. 随着仿制药涌入,利格列汀片国内市场将重新洗牌
利格列汀可谓名副其实的“明星降糖药”,近年国内市场以亿元为单位增长,2023年全年市场销售额超15亿元。
首仿企业广东东阳光在2022年遭受侵权撤网风波的情况下仍斩获了7684.74万元的市场销售额,2023年下半年广东东阳光重新恢复挂网资格开始回到市场中,并在年末总共获得了超5000万元的销售额。
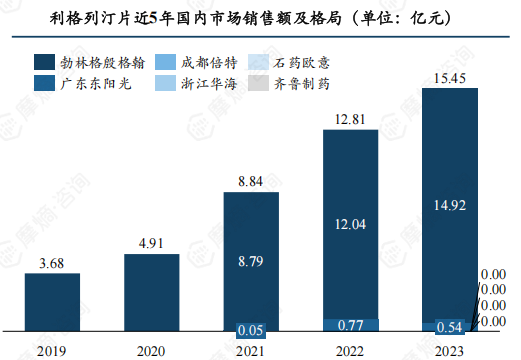
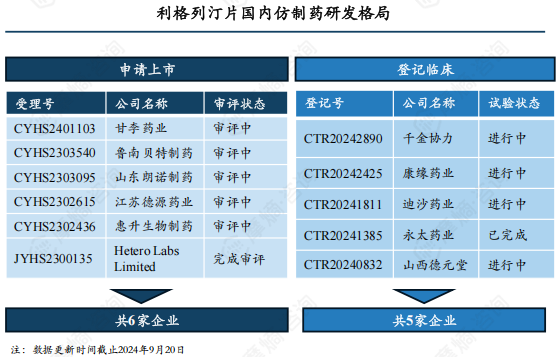
随着原研专利全部到期失效,将有更多仿制药涌入市场。除获批上市的7家外,还有6家正在申报上市(1家已完成审评),5家在开展BE试验(1家试验已完成),仿制药市场竞争俨然一幅激烈景象,进入集采之后利格列汀片国内市场格局将重新洗牌,未来市场主位花落谁家,可拭目以待。
(四)XIFAXAN®
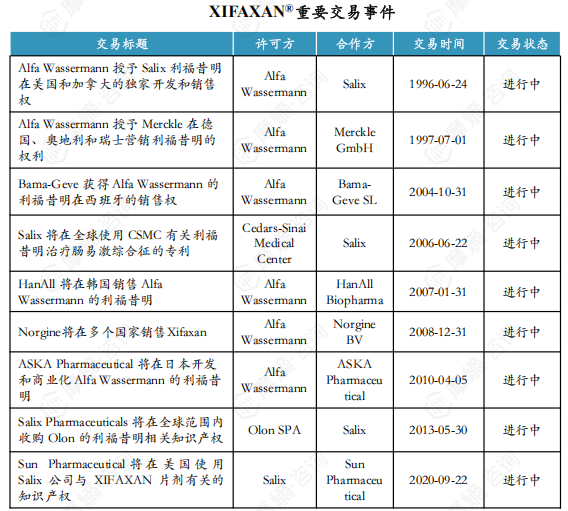
1. XIFAXAN® 药物简介及重要交易事件
商品名:XIFAXAN ® (昔服申)
通用名:利福昔明片
活性成分:利福昔明α晶型
首次获批时间:1988-10-13(意大利)
原研企业:Alfa Wassermann SpA (阿尔法韦士曼制药)
适应症:肠道感染、肝性脑病、肠易激综合征、憩室病
作用机制:利福昔明是利福霉素类抗菌药物,能与细菌的DNA依赖性RNA多聚酶β亚基发生不可逆结合而抑制细菌RNA合成,最终抑制细菌蛋白质的合成。利福昔明具有广泛的抗菌谱,对多数革兰阳性菌和革兰阴性菌,包括需氧菌和厌氧菌具有杀菌作用。利福昔明有5种不同的晶型(α、β、 γ、δ和ε),不同晶型间的药理存在显著差异,α晶型利福昔明在胃肠道中几乎不被吸收。由于胃肠道的吸收非常低,多晶型α的利福昔明局部作用于肠腔,对侵入性致病菌无临床疗效。
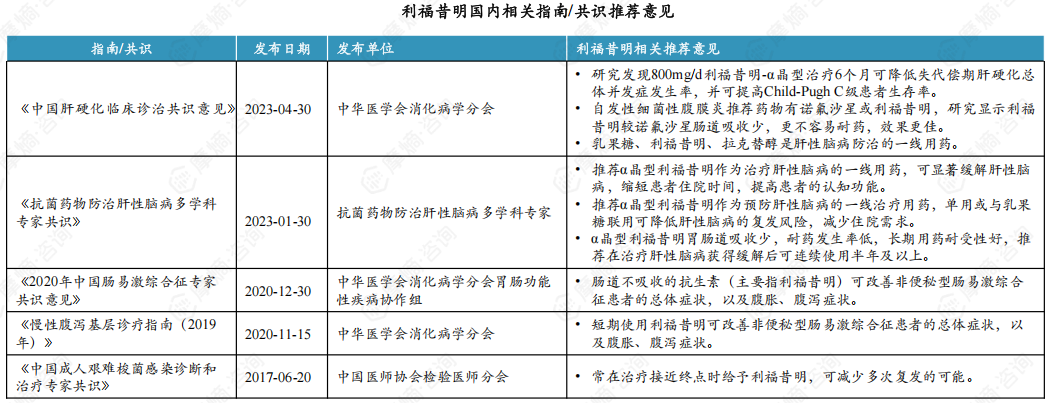
2. 国家权威指南肯定利福昔明治疗肠道感染和肝性脑病的临床优势
α晶型利福昔明口服后吸收率很低,在肠道内易形成较高的药物浓度并发挥抗菌活性,因此,对肠道感染相关疾病疗效确切。同时,其可能通过改善肠道菌群紊乱,减轻炎症反应,调节肠道免疫等机制,在一些慢性肠道炎症和肠功能紊乱的治疗中发挥作用,且对正常菌群影响较小、安全性好。此外,利福昔明还可能通过调节肠道菌群改善内毒素血症,进而影响肠-肝轴的作用防治肝性脑病。此外还有研究发现,其对肝硬化其他并发症的防治和延长慢性肝病患者生存期均有积极作用,显示出广阔的应用前景。
3. 利福昔明片:口服不吸收广谱抗生素,疗效确切,耐受性好,前景广阔
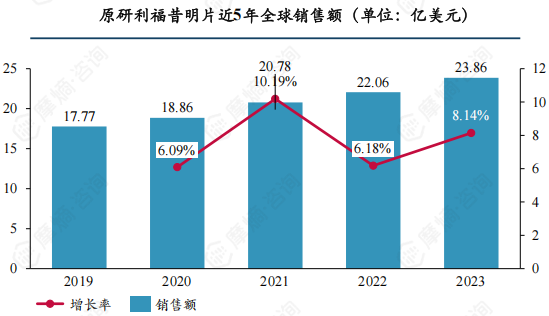
利福昔明片是一款经典肠道抗感染药物,活性成分为α晶型利福昔明,主要用于肠道感染和高氨血症(肝性脑病)的辅助治疗,已在全球多个国家上市使用多年,积累了庞大的市场基础,近年销售额仍在稳健上升,2023年全球销售额约23.08亿美元。
利福昔明治疗克罗恩病、假性肠梗阻、镰状细胞性贫血等多种疾病的研究已进入临床阶段,目前克罗恩病在欧洲已进入III期临床,假性肠梗阻和镰状细胞性贫血分别在日本和美国开展II期临床研究。

4. 利福昔明片原研中美核心专利信息一览
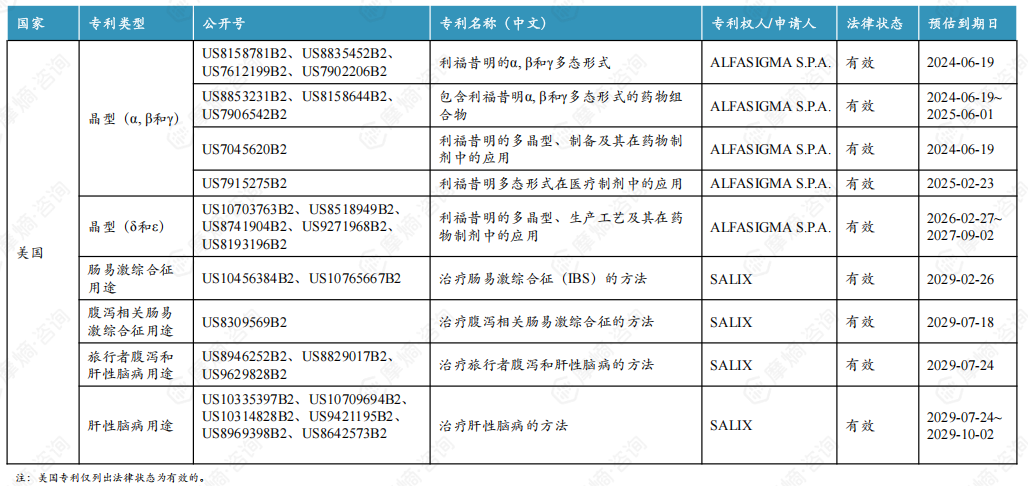
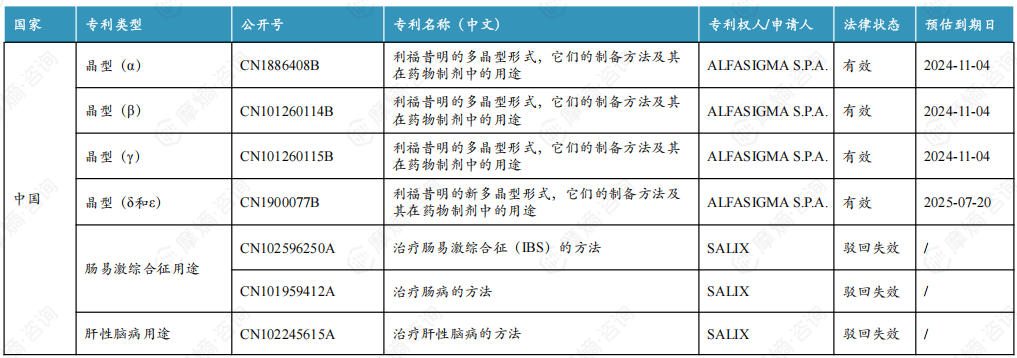
进口原研说明书明确指出利福昔明片的活性成分为利福昔明α晶型,原研α晶型在中国的专利权已于2024年11月4日到期。除α晶型外,原研还布局了β、 γ、δ和ε晶型的专利,其中β和 γ晶型专利将与α晶型一同到期, δ和ε晶型专利将于2025年7月20日到期。但原研并未在中国上市药品专利信息登记平台登记相关专利信息。
原研曾计划在国内布局肠易激综合征和肝性脑病用途专利,但均以被国家知识产权局驳回失效告终。
5. 原研利福昔明片核心晶型专利届满日近在咫尺,但临床难度令仿制药企望而却步
事实上,国内已有利福昔明仿制药上市并应用多年,但都是未通过一致性评价的老批文,获批剂型包括片剂、干混悬剂、胶囊剂。据摩熵销售数据库显示,近年胶囊剂已退出市场,目前主要应用剂型为片剂,干混悬剂在市场中也还占有一席之地。
国内利福昔明制剂市场向好,5年市场增速为26.13%,2023年市场增量更是超2000万元,销售额达7035.51万元,其中有6459.38万元来自利福昔明片。
目前国内利福昔明片市场几乎全部落入原研囊中,仿制药市场占比不到1%。
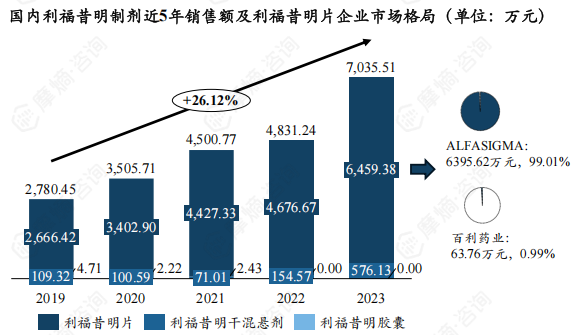
作为一款经典肠道抗感染药物,同时又因其药理作用特点而具有广阔市场前景,利福昔明在国内布局的核心专利将于不久后的2024年11月4日到期失效,然而至今仍无任何一家国内仿制药企跟进仿制的消息,已获得老批文的企业也没有进一步开展一致性评价,推测跟利福昔明特殊的药理作用(几乎不吸收,局部作用)导致其临床研究难度大、成本高有关。
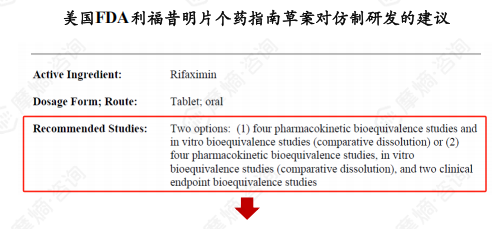
研发建议:
两种选择:(1) 四项以药代动力学为终点的生物等效性研究和体外生物等效性研究(比较溶出度);(2)四项以药代动力学为终点的生物等效性研究和体外生物等效性研究(比较溶出度)和两项临床终点生物等效性研究。
(五)SPRYCEL®
1. SPRYCEL® 药物简介及重要交易事件
商品名:SPRYCEL® (施达赛)
通用名:达沙替尼片
活性成分:达沙替尼一水合物
首次获批时间:2006-06-28(美国)
原研企业:Bristol-Myers Squibb Co (百时美施贵宝,BMS)
适应症:急性淋巴细胞白血病、慢性粒细胞白血病
作用机制:达沙替尼属于蛋白激酶抑制剂,可抑制BCR-ABL激酶和SRC家族激酶以及许多其它选择性的致癌激酶,包括c-KIT、ephrin(EPH)受体激酶和PDGFβ受体。达沙替尼是一种强效的、次纳摩尔(subnanomolar)的BCR-ABL激酶抑制剂,其在0.6-0.8nM的浓度下具有较强的活性。它与BCR-ABL酶的无活性及有活性构型均可结合。体外研究中,达沙替尼在表达各种伊马替尼敏感和耐药疾病的白血病细胞系中具有活性。此外,达沙替尼可在次纳摩尔浓度下抑制SRC家族激酶。
达沙替尼片由研发BMS,2006年6月首次在美国获批上市,用于治疗对甲磺酸伊马替尼耐药或不耐受的费城染色体阳性慢性粒细胞白血病以及费城染色体阳性急性淋巴细胞白血病。在美国本品可用于1岁及以上的儿科患者。2011年9月7日,原研在中国获批进口,在中国仅用于治疗对甲磺酸伊马替尼耐药或不耐受的费城染色体阳性慢性粒细胞白血病成年患者。
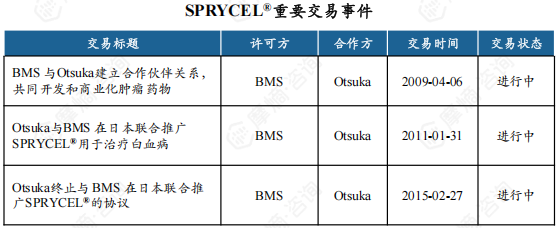
2009年4月, BMS与Otsuka达成合作共同开发和商业化包括达沙替尼在内的血液肿瘤药物。2011年1月Otsuka同意与BMS联合在日本推广达沙替尼片。2015年2月Otsuka终止了在日本联合推广的达沙替尼片协议, BMS独自接手了日本市场的推广业务,这一变动不影响双方公司在达沙替尼片上的其他合作事宜。
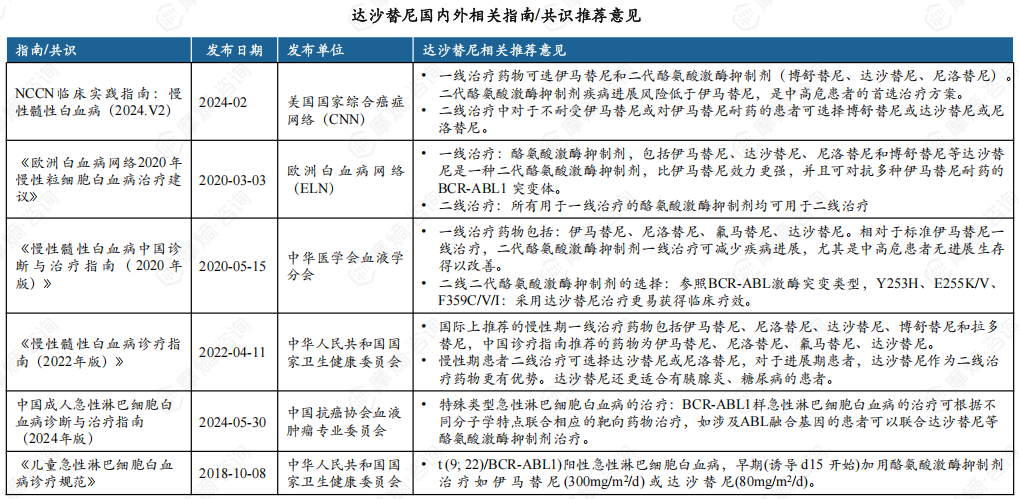
2. 国内外权威指南均支持达沙替尼治疗白血病临床地位
3. 达沙替尼片:第二代酪氨酸激酶抑制剂,原研产品全球销售额超20亿美元
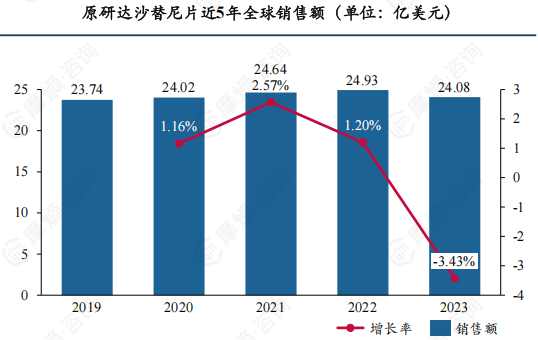
达沙替尼片为第二代酪氨酸激酶抑制剂,上市后临床应用广泛,可用慢性髓性白血病于一线和二线治疗。2019年全球市场已超20亿美元,此后三年缓慢增长,2022年达24.93亿美元,2023年有小幅下降,降至24.08亿美元。
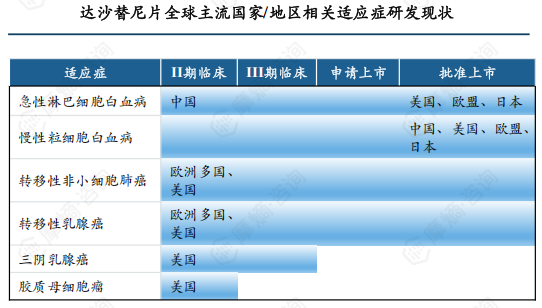
达沙替尼片已获批的适应症为甲磺酸伊马替尼耐药或不耐受的费城染色体阳性慢性粒细胞白血病(又称慢性髓性白血病)和费城染色体阳性急性淋巴细胞白血病,但在中国仅用于治疗慢性髓性白血病,急性淋巴细胞白血病还停留在II期临床阶段。
近年来欧美地区对达沙替尼片在其他肿瘤治疗的潜力展开了研究,其中转移性非小细胞肺癌、转移性乳腺癌、三阴乳腺癌、胶质母细胞瘤方面的研究已进入II期临床。
4. 达沙替尼晶型专利壁垒遭石药欧意攻破,至此原研国内专利全部无效
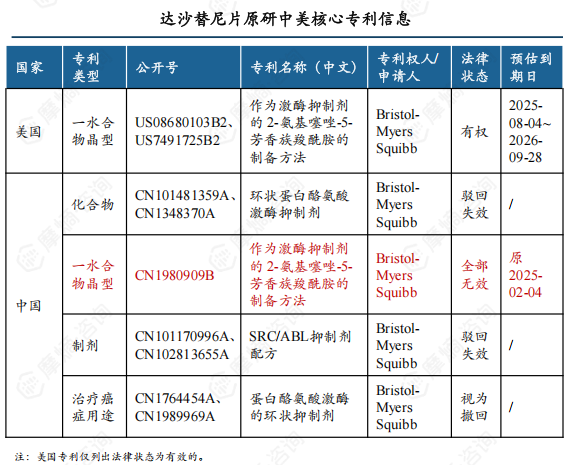
原研公司未在中国上市药品专利信息登记平台登记达沙替尼片相关专利信息。
2020.12.04 石药欧意以不符合专利法第22条第3款(不具备创造性)为由对原研达沙替尼一水合物晶型专利提出无效请求。
2021.05.21 国家知识产权局发布无效宣告请求审查决定书,宣告专利全部无效。

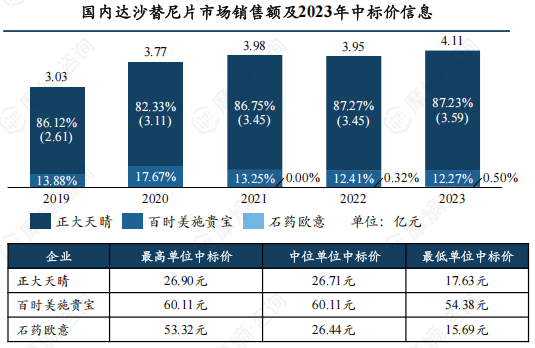
5. 承天时地利,正大天晴抢占先机稳居国内达沙替尼片市场主位多年
达沙替尼片国内目前已有5家仿制药企业获批上市,其中正大天晴药业为首仿企业,但比较特殊的是正大天晴首次获批是在2013年9月,未经过一致性评价,直到2021年5月才通过一致性评价正式成为过评品种。
北京双鹭药业已完成达沙替尼片的BE试验,预计很快将申报上市。
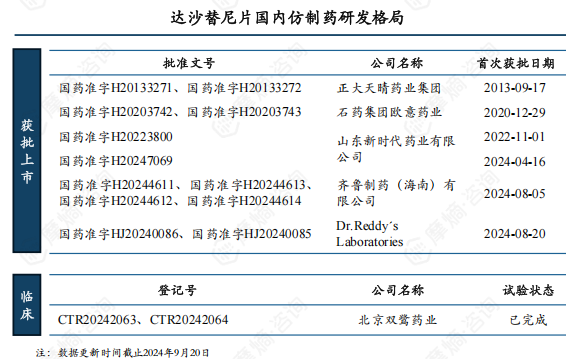
据悉,正大天晴仿制的达沙替尼片所使用的活性成分为不带水的晶型,而非原研的一水合物晶型,因此不存在专利侵权问题,上市后便开始推广销售,原研公司也未对这一行为提起侵权诉讼。因正大天晴仿制药价格的优势,很快取代原研抢占了国内市场大头,近5年其市场份额更是稳定保持在80%以上,2023年销售额超3亿元。2021年正大天晴达沙替尼片成功通过一致性评价,进一步稳定了其市场地位。
随着原研专利失效,众多仿制药企布局进入市场,其中包括成功无效原研专利的石药欧意。
四、总结
1. 从专利即将到期重磅小分子药品看专利攻防策略
关于原研药品专利规避/挑战
(1)晶型专利、组合物、制剂专利有较大概率无效挑战成功,化合物专利无效则比较困难。 如利格列汀片的晶型专利和制剂专利被全部无效,化合物专利则无效挑战失败。但对于不同晶型药理作用存在显著差异的药物,其晶型专利几乎等同于化合物专利,无效难度较大,如利福昔明α晶型。
(2)需要提早对原研药专利布局进行深度挖掘,发现具有开发潜力的布局空白点或专利空隙,在避免侵权的情况下进行仿制药研发,紧跟技术脚步。如可考虑研发不同水合物或盐型以规避原研活性成分相关专利(例:南京一心和研发出沙库巴曲缬沙坦钠3水合物以规避原研2.5水合物的晶型专利;正大天晴研发出不带水的碱基达沙替尼以规避原研的一水化合物专利)。
(3)对于药械一体化的吸入药品原研公司在布局专利时除了注重活性成分、组合物、晶型等专利外,给药装置专利也会重点布局,因此给药装置专利也可能有较大的侵权风险,且给药装置的设计很大程度上会影响药物的吸收,要规避这类专利存在较高的技术壁垒。
关于原研药品专利防守
(1)原研企业在布局专利时会尽可能考虑周全,通常不会只保护一种晶型或盐型,避免仿制药企业以研发类似新晶型或盐型的方式来规避专利侵权风险。
(2)面对仿制药企业发起的专利挑战和进攻,原研公司会采取与其他仿制药企协议和解的方式来避免专利悬崖,降低市场损失。如南京正大天晴沙库巴曲缬沙坦钠片未能无效掉原研2.5水合物晶型,原研授予其0-3水合物晶型专利实施许可;江苏华瀚医药则获得沙库巴曲缬沙坦钠片原研所有晶型专利的实施许可。
2. 从专利即将到期重磅小分子药品看药品专利制度的意义和影响
药品专利链接制度的意义和影响
(1)药品专利链接制度有利于提早解决专利纠纷,维护市场公平
东阳光药业在利格列汀原研化合物专利还未到期的情况下获得批文后便挂网上市销售,这一侵权行为出现在药品专利链接制度正式确立之前,该行为后果给原研企业、仿制药企业甚至医疗机构都造成不小影响,可见药品专利链接制度这一调节机制的重要性。
正大天晴仿制的达沙替尼片上市于仿制药一致性评价制度推行之前,更是在药品专利链接制度确立之前,上市后迅速占领市场,据悉正大天晴仿制药所用的活性成分为自主研发的新晶型,不存在侵权问题,但有仿制药企对此持怀疑态度。原研公司没有对正大天晴提起侵权诉讼,据悉是因为几乎同一时间原研正在忙于争夺欧洲、美国、加拿大三地的专利权,且维权官司时间持续将近4年之久,原研公司疲于应对中国的侵权事件。如果早有药品专利链接制度加持,则原研公司能在正大天晴申报上市期间就收到其可能侵权的消息,进而早期进行维权操作,可能就不会陷入捉襟见肘的窘境。由此可见药品专利链接制度有利于提早解决专利纠纷,维护市场公平。
(2)药品专利链接制度促使专利声明登记规范化,有效防止侵权事件的发生
药品专利链接制度正式确立实施后,专利声明登记趋于规范,几乎所有仿制药在申报上市时都登记了相应的专利声明,能有效防止侵权事件的发生。
(3)金无赤金,药品专利链接制度也存在一些问题
药品专利链接制度降低了仿制药企的专利检索成本,有利于仿制药企提前布局专利规避策略,这直接拉高了原研专利遭受无效挑战的风险,而原研企业通常采取和解的方式解决危机,从而容易导致垄断发生。
以上内容均来自摩熵咨询{专利即将到期五大重磅小分子药品,国内仿制药“战况”几何?},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论