
跟随“中国科学院生物学部第一个下海的院士”一起创业,是一种怎样的体验?
近年来,在快速推进的溶瘤病毒赛道中,一款“中美双报”抗癌药物引发关注。
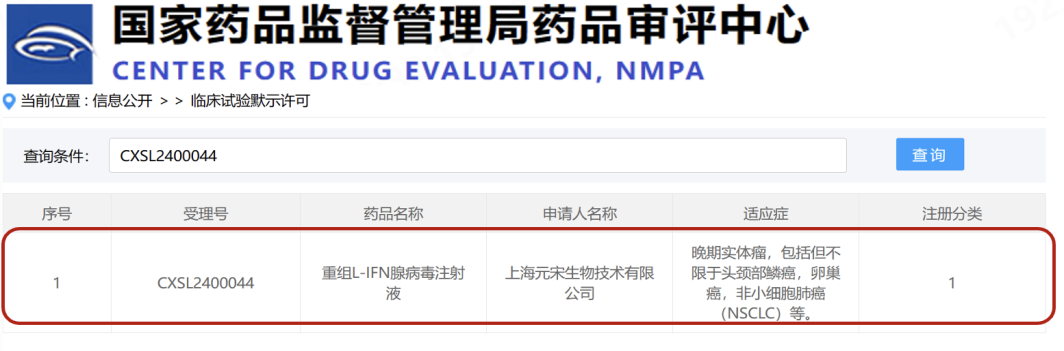
这款由上海元宋生物技术有限公司(以下简称“元宋生物”)研发的重组L-IFN腺病毒注射液YSCH-01,已分别获得美国食品药品监督管理局(FDA)关于I期注册临床试验的批准,以及中国国家药品监督管理局药品审评中心(CDE)的默示许可。
目前,YSCH-01在中国多家三甲医院的I期临床试验正在积极进行中。
从2001年中国科学院院士、中国科学院分子细胞卓越创新中心研究员刘新垣提出“癌症的靶向基因-病毒抗癌学说”的研究路线基础,到2006年成为刘新垣院士门下的研究生,再到2017年正式跟随导师“下海创业”并实现“双报双批”,在元宋生物联合创始人、总经理章康健看来,这是一场超过20余年的路线接力,也是一场关于溶瘤病毒到底能不能实现“一箭多星”的理论实证。

“如果不能学以致用,是一件很遗憾的事情。这也是我们作为科研团队,想要出来创业的初心。”在接受采访时,章康健这样说道。
像“蚯蚓拱土”,
溶瘤病毒如何“搅”肿瘤的巢穴
在学术界一直有个讨论:
溶瘤病毒是单纯的病毒疗法,
还是免疫治疗?
“我们可能更强调后者,
我们觉得这是肿瘤免疫治疗的
一个分支方向的产品。”
传统的溶瘤病毒旨在通过病毒载体精确裂解癌细胞,是单纯的病毒疗法。而在2001年,来自中国科学家的创新理论,为这一技术路线带来革新。
刘新垣院士综合溶瘤病毒和基因治疗优缺点,提出“癌症的靶向基因―病毒治疗(Cancer Targeting Gene-Viro-Therapy,CTGVT)”策略,即将基因治疗与溶瘤病毒治疗结合起来,将抗癌基因插入到溶瘤病毒中:一方面利用基因治疗的优势,用癌细胞大量生产抗癌蛋白;同时,病毒本身也可以裂解肿瘤;而这两个通路同时也能激发全身性的抗癌免疫。
“就像航天工程,一枚火箭可以携带多个卫星,实现‘一箭多星’。如果火箭就是病毒载体的话,卫星则是我们插入的抗癌基因,会继续在体内‘发射抗癌信号’。”作为跟随刘新垣院士学习与工作最久的学生,章康健向记者解释道。
让局部给药带动全身免疫,
可谓是“癌症的靶向基因—病毒治疗”
策略的最后一步“大招”:
“溶瘤病毒进入肿瘤就像蚯蚓拱土,不把肿瘤的巢穴给搅一搅,后面的免疫细胞就进不来,无法发挥免疫作用,就不能有效杀伤肿瘤。”
目前同类型上市和在开发产品,抗癌机制多依赖于T细胞免疫;同时对于晚期免疫系统被破坏的癌症病人效果差,且易引起细胞因子风暴。元宋生物基于自主原创的病毒设计可激发人体NK细胞免疫并呈现显著的肿瘤免疫记忆,该极具创新性的抗癌机制显著区别于其他依赖T细胞激活抗癌的溶瘤病毒竞品。逆转免疫刹车蛋白PD-L1阴性肿瘤成强阳性,为联合免疫检验点单抗序贯联合用药提供了理论基础。
“我们很大的创新是在源头上,强调‘基因+病毒’,而不是单纯改造病毒来杀癌细胞。我们强调插入的基因要有非常好的疗效,病毒载体也要非常安全,从而做到靶向溶瘤。”
化“相克”为“相生”
让“1+1”真正“大于2”
“基因治疗+溶瘤病毒”,这个路线听起来只是技术的叠加,但做起来却又会真实地遇到诸多困难。转化“CTGVT”为“YSCH-01”的过程,足足花了团队20年时间。

“实际做的时候,很多情况下反而会做出反例——基因病毒疗法还不如单纯病毒载体的效果好,关键就在于Know-How。”章康健说道,“例如插入的基因,很可能会和病毒载体‘打架’,亦或者是不协调,反而拖累彼此。”
在插入基因的选择上,团队也曾有过迷茫。“2005年,刘院士课题组也想过,是不是一个载体要带很多个基因,能实现更好的效果?这些尝试我们都做过。”
更多的基因片段,意味着更严格的质量控制和更繁复的工艺设计。最终团队选择“化繁就简”:如果设计一个基因片段,能够顶上多个基因,那相关成本便可以大大降低,也就是说,最终还是要回到技术创新的源头,回到最根源的问题——在细胞生物学层面,哪些通路真正具有抗癌作用?
为此,团队发表了超过120多篇论文,大浪淘金,最终把目光放在了干扰素上——一个近30年来在抗癌药物发展中起到关键作用的信号通路因子。“在细胞生物学层面,近几十年来,许多脱颖而出的抗癌疗法其实都激发了一条十分重要但有枢纽中心作用的下游信号通路,即I型干扰素信号通路。”但干扰素偏偏在调动免疫调节的同时,又还具有抗病毒的作用。如果直接加进干扰素基因,便很可能 “1+1=0”。
方向有了,下一步就是如何改造。“我们把抗病毒的细胞因子变成一个具抗癌作用的活性细胞因子,改变功能结构从而实现多途径抗癌的目的,这就是我们独特的Know-How。”
从源头发现,到给药方式,创新可谓贯穿研发始终。“除了肿瘤内给药,我们还有胸腔给药、雾化给药、腹腔给药,甚至直接颅内给药。”章康健介绍道,多元化的给药方式为临床实际操作带来了诸多便利,也进一步提升了药效。
在正式进入临床试验之前的研究者发起的临床研究(IIT)论文数据表明,YSCH-01表现出了不俗的实力:临床统计分析结果显示,瘤内给药后的客观缓解率(ORR)为27.3%,疾病控制率(DCR)为81.8%。近期临床雾化给药肺部多发肿瘤抗癌数据ORR 为60%,一例颅内给药的复发胶质瘤患者至今生存期近400天,而此类患者一般的生存期仅6个月。
“我们的药在包括肺癌、头颈癌、三阴性乳腺癌、黑色素瘤、胶质瘤、卵巢癌、骨肉瘤等7个晚期实体肿瘤上,都有非常好的抑瘤效果,超越了过去很多溶瘤病毒的疗效。”
“科研团队出来创业,向产业化成功的转型,一个标志性事件就是把药‘打’到临床上去,即迈入国家批复的正式临床试验。”20年科研在这两年收获丰碑——YSCH-01已分别获得了美国FDA(IND#:30099)和中国CDE(批准编号:2024LP00904)注册I期临床试验的批准和默示许可,其在中国境内多家三甲医院的I期临床试验正在积极推进中。
跨近60岁的“忘年”创业——
想把自己做的原始创新真正产业化
事实上,随着刘新垣院士提出“溶瘤病毒+基因治疗”的CTGVT策略,业界也已形成新的趋同共识,并有所尝试,包括美国和日本在内已有相关药品获批上市,治疗恶性黑色素瘤、胶质瘤等肿瘤。
既然业界已有相关尝试,
为什么还要自己做成果转化?
章康健认为,一方面,在于目前市场上溶瘤病毒+基因治疗路线的产品在疗效方面仍然不够理想。近十年来,尽管产品屡有报道,但真正突破性产品仍然稀缺。
另一方面,自己与刘新垣院士也都有一颗科研产业转化的初心。早在90年代,刘新垣院士就曾“下海”创业,将自己在细胞因子方面的研究进行成果转化,成为了中国科学院生物学部“吃螃蟹的第一人”
“2006年,我向刘院士求学时,他问我‘你为什么选我做导师,因为我是院士吗?’。我说‘不是,因为您是一位具有科研产业化思想并具有成功产业经验的科学家’。”
因此,2015年年底,刘新垣院士给正在美国宾夕法尼亚大学访学的章康健发邮件,谈到再次“下海”的想法时,师生之间一拍即合。章康健归国不久,立即投入到公司的创办中。
此时,刘新垣院士已年近九旬,而章康健才三十多岁,“我们一老一少,有时候投资人看到都觉得不搭,觉得很困惑,但我们就这样硬生生真的做下来了。”
做药需要穿越起伏的行业周期,才得以见到“柳暗花明”。“在2020年之前,行业对溶瘤病毒还是充满极高热情的,但这几年,没有重磅级的成果产出,有些从业者就陆续放弃了。”对于创新药研发者来说,更需要一颗对于技术的坚定决心,“有好的技术、好的产品,才会有投资者、同行、医学专家和你一起同向赋能,这是最核心的东西。”
“长期以来,上海市对基因和细胞治疗产业给予了高度关注和支持,推出了《上海市促进基因治疗科技创新与产业发展行动方案(2023-2025年)》等多项政策措施鼓励创新,促进科技成果的转化和产业化,这些都是上海这座城市无可替代的优势。”
诞生于中国科学院的实验室,扎根于奉贤区凤创谷生物科技园,元宋生物曾先后承担2017-2019年上海市科技型中小企业技术创新资金2项、上海市2019年度“科技创新行动计划”生物医药领域科技支撑项目等,并得到高新技术企业认证及配套扶持以及市区两级多项人才认证。
新药开发进程中,从研发、临床试验,再到上市,每一关都是九死一生,流传着“3个十”,即需要超过10年时间、10亿元的研发投入,不到10%的成功率,才有可能研发出一款新药。
章康健带领元宋团队选择这条路,注定十分艰辛。
作为一名溶瘤病毒抗癌药物科研产业化积极践行者,十八年求索,在真正把药推进临床后,章康健对于抗癌药物从研究到临床转化所蕴含的个人价值以及社会价值,都有了更为深刻且透彻的理解。
参与临床试验的患者,都需要进行严格评估,大多还是癌症晚期的末线受试者。做YSCH-01临床研究期间,章康健的一位亲人也入了组,成为首位临床受试患者。
“很多晚期癌症患者生存期只有几个月,但在我们的药物下,他的生存期持续了两年多。这其实是很难得的。”
“我想我是这样的人,
我最开心的时光,
就是患者打电话对我说
感觉到了药效,
这是对我最大的肯定。”
章康健说道。

企业及专家观点不代表官方立场



↓分享
↓点赞

↓在看





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论