1.5.1 本周全球TOP10创新药研发进展
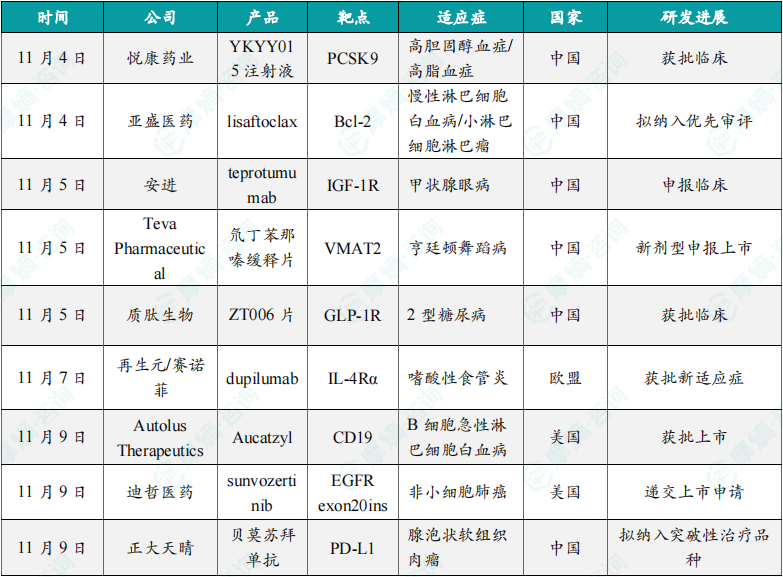

(1)悦康药业PCSK9靶向siRNA药物在中国获批临床,针对高胆固醇血症/混合型高脂血症
11月4日,悦康药业公告宣布,其全资子公司杭州天龙药业申报的YKYY015注射液在中国获批临床,拟开发治疗以LDL-C升高为特征的原发性(家族性和非家族性)高胆固醇血症或混合型高脂血症的患者。YKYY015是杭州天龙自主开发的靶向PCSK9基因的小干扰核糖核酸(siRNA)药物,有望实现一年仅需注射2次。根据悦康药业公告介绍,YKYY015具有全新的序列,采用了其自主研发的siRNA序列全新修饰模板和GalNAc递送系统,能够实现高效的肝靶向递送。该产品有望实现一年仅需注射2次,便可持续抑制肝脏中PCSK9蛋白的合成,从而高效降低血浆中的LDL-C水平,切实有效控制血脂。
(2)亚盛医药新型口服Bcl-2选择性抑制剂lisaftoclax拟纳入优先审评
11月4日,中国国家药监局药品审评中心(CDE)官网最新公示,亚盛医药申报的力胜克拉片(lisaftoclax,APG-2575片)拟纳入优先审评,针对适应症为难治或复发性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。APG-2575是亚盛医药自主研发的新型口服Bcl-2选择性抑制剂,通过选择性抑制Bcl-2蛋白,恢复癌细胞的正常凋亡过程,从而达到治疗肿瘤的目的。该产品此前共获5项美国FDA授予的孤儿药资格,用于治疗华氏巨球蛋白血症(WM)、慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)、急性髓系白血病(AML)、以及滤泡性淋巴瘤(FL)。
(3)安进“first-in-class”抗体新药在中国申报临床,针对甲状腺眼病
11月5日,中国国家药监局药品审评中心(CDE)官网最新公示,由Horizon Therapeutics和安进(Amgen)共同申报的teprotumumab的新药临床试验申请(IND)获得受理。公开资料显示,这是一款“first-in-class”靶向IGF-1R的单抗,也是首款获得美国FDA批准治疗甲状腺眼病的创新疗法。2023年10月,安进以总价值278亿美元完成对Horizon公司的收购,从而获得这款产品。该产品还于2023年入选了被誉为“医药界的诺贝尔奖”的盖伦奖(Prix Galien USA Awards)最佳罕见病产品奖(候选产品)。
(4)梯瓦公司亨廷顿舞蹈病新药氘丁苯那嗪缓释片在中国申报上市
11月5日,中国国家药监局药品审评中心(CDE)官网最新公示,由梯瓦(Teva Pharmaceuticals)公司申报的5.1类新药氘丁苯那嗪缓释片上市申请已获得受理。公开资料显示,氘丁苯那嗪是一款囊泡单胺转运蛋白 2(VMAT2)抑制剂丁苯那嗪的氘代药物,此前已经在中国获批治疗亨廷顿舞蹈病和迟发性运动障碍。本次是该产品的缓释片新剂型在中国申报上市。丁苯那嗪是一类囊泡单胺转运体2(VMAT2)抑制剂。它主要通过可逆性的抑制中枢神经系统的VMAT 2来降低单胺类化合物,如5‑羟色胺,多巴胺和去甲肾上腺素等的供应,从而产生药理活性。过往大量研究已经证明了VMAT作为各种神经病理状态药物治疗靶点的意义。
(5)质肽生物新一代口服GLP-1药物ZT006片获得临床试验默示许可
11月5日,中国国家药监局药品审评中心(CDE)官网刚刚新公示,质肽生物1类新药ZT006片获得临床试验默示许可,拟开发用于成人2型糖尿病患者的血糖控制。公开资料显示,ZT006 是一款新一代口服GLP-1药物,为新一代口服蛋白药品种,主要治疗糖尿病和肥胖症。经过优化的ZT006具有较高的生物利用度,有希望成为继口服司美格鲁肽之后的新一代口服GLP-1品种。口服给药是公认的、可以显著提高慢性病患者依从性的一种给药方式。
(6)再生元/赛诺菲IL-4Rα抑制剂dupilumab在欧盟获批嗜酸性食管炎适应症
11月7日,再生元(Regeneron Pharmaceuticals)与赛诺菲(Sanofi)宣布,其重磅疗法Dupixent(dupilumab)获欧盟批准用于治疗嗜酸性食管炎(EoE)儿童患者。该批准涵盖1至11岁、体重至少15公斤且病情无法充分获得控制、无法耐受或不适合常规药物治疗的儿童。根据新闻稿,Dupixent是在欧盟获批用以治疗此年龄段EoE儿童患者的首个药物。Dupixent是一种完全人源化的单克隆抗体。此抗体通过靶向IL-4与IL-13受体共有的IL-4Rα亚基来抑制IL-4与IL-13通路,进而抑制像是促炎症细胞因子、驱化因子、氧化氮和免疫球蛋白E等造成炎症反应的细胞因子释放。Dupixent目前已被批准用于治疗哮喘、特应性皮炎、慢性鼻窦炎伴鼻息肉病(CRSwNP)与嗜酸性食管炎。
(7)Autolus Therapeutics新一代CAR-T疗法获FDA批准,治疗B细胞急性淋巴细胞白血病
11月9日,Autolus Therapeutics宣布,美国FDA已批准Aucatzyl(obecabtagene autoleucel,obe-cel)用于治疗复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的成年患者。Aucatzyl是一款靶向CD19抗原的自体CAR-T细胞疗法。它旨在克服当前CAR-T细胞疗法在临床活性和安全性方面的局限性。此前,该疗法已被美国FDA和欧洲药品管理局(EMA)授予孤儿药资格,还获得美国FDA授予的再生医学先进疗法(RMAT)认定以及EMA授予治疗成人复发/难治性B细胞急性淋巴细胞性白血病的PRIME认定。根据新闻稿,Aucatzyl是获美国FDA批准的首个无需风险评估缓解策略计划(REMS)的CAR-T疗法。
(8)迪哲医药新型肺癌靶向药舒沃替尼片向美国FDA递交上市申请
11月9日,迪哲医药(Dizal)宣布,公司已于近日向美国FDA递交舒沃哲(sunvozertinib,舒沃替尼片)的新药申请(NDA),用于既往经含铂化疗治疗时或治疗后出现疾病进展,并且经FDA批准的试剂盒检测确认,存在表皮生长因子受体(EGFR)20号外显子插入突变(exon20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。舒沃哲是一种理性设计的选择性、不可逆的EGFR exon20ins抑制剂,是由迪哲医药自主研发的新型肺癌靶向药。该疗法于去年8月通过优先审评在中国获批上市,已成为EGFR exon20ins NSCLC二/后线标准治疗方案。舒沃哲此前已获FDA授予突破性疗法认定,用于全线治疗EGFR exon20ins NSCLC患者。
(9)正大天晴PD-L1肿瘤联合疗法在中国拟纳入突破性治疗品种
11月9日,中国国家药监局药品审评中心(CDE)官网最新公示,正大天晴抗PD-L1单抗1类新药贝莫苏拜单抗(TQB2450)拟纳入突破性治疗品种,适应症为与盐酸安罗替尼胶囊联合用于腺泡状软组织肉瘤患者的治疗。据正大天晴公开资料介绍,抗血管生成酪氨酸激酶抑制剂(TKI) 安罗替尼联合抗PD-L1抗体贝莫苏拜单抗在针对泛肉瘤患者的2期临床试验中显示出较好的抗肿瘤疗效,特别是在腺泡状软组织肉瘤(ASPS)队列中。本次贝莫苏拜单抗联合安罗替尼拟纳入突破性治疗品种,意味着该联合疗法在又一项适应症上取得新的突破。
(10)绿叶制药1类新药LPM682000012片获得临床试验默示许可,针对抑郁症
11月9日,中国国家药监局药品审评中心(CDE)官网近日最新公示,绿叶制药申报的1类新药LPM682000012片获得临床试验默示许可,拟开发治疗抑郁症。通过CDE官网查询可知,这是该产品首次在中国获批临床。根据受理号可知,这是一款小分子化药。根据绿叶制药公开资料,该公司研发的化药1类创新药盐酸托鲁地文拉法辛缓释片此前已经在中国获批上市,这是一款5-HT/NE/DA再摄取抑制剂;每月一次的棕榈酸帕利哌酮缓释混悬注射液已经获美国FDA批准上市,可抗抑郁药的辅助疗法用于分裂情感性障碍成人患者的治疗。
1.5.2本周全球TOP10积极/失败临床结果
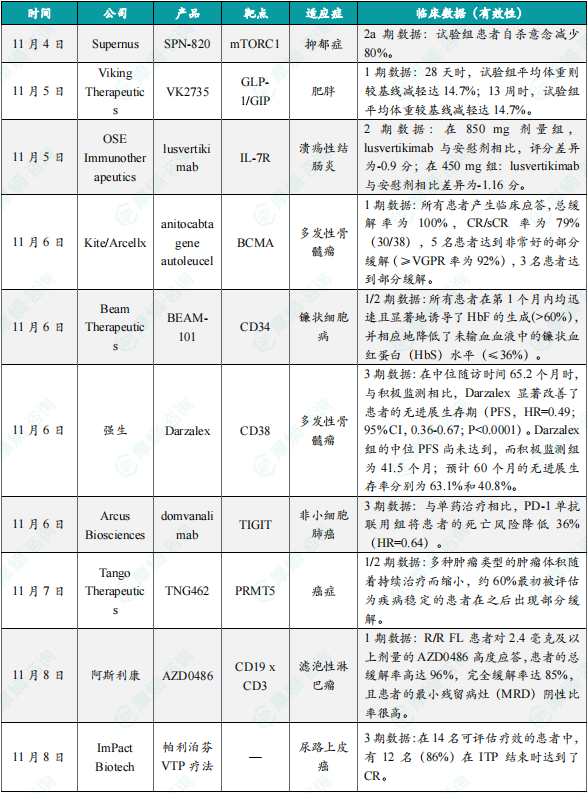
(1)Supernus潜在“first-in-class”小分子抑郁症疗法2a期临床结果积极
11月4日,Supernus Pharmaceuticals公布其潜在“first-in-class”在研小分子疗法SPN-820用以治疗抑郁症(MDD)成人患者的探索性开放标签2a期临床研究的积极数据。这次所公布的2a期研究检视了每三天使用一次2400毫克SPN-820作为抗抑郁基础治疗的辅助疗法的安全性和耐受性。该研究纳入了40名受试者,其中38名完成了10天的治疗期。分析显示,SPN-820的疗效迅速,患者接受治疗4小时后,分别有50.0%和35.0%的患者产生蒙哥马利阿斯伯格抑郁量表(MADRS)所评估的应答(评分减少≥50%)和MADRS缓解(MADRS评分≤10)。此数值到第10天则进一步改善至84.2%和63.2%。此外,患者的自杀意念减少了80%(从基线时的12.5%到第10天时的2.6%)。SPN-820的耐受性良好,不良事件(AE)很少,因AE导致的停药率低(2.5%)。
(2)Viking Therapeutics在研减重疗法GLP-1/GIP受体联合激动剂VK2735数据积极
11月5日,Viking Therapeutics在肥胖协会年会肥胖周(ObesityWeek)当中公布其在研减重疗法胰高血糖素样肽1(GLP-1)/葡萄糖依赖性胰岛素促泌肽(GIP)受体联合激动剂VK2735的最新临床数据。分析显示,接受每日VK2735口服片剂28天的受试者,其平均体重较基线减轻达8.2%。而接受每周VK2735皮下注射治疗13周的肥胖患者的平均体重则较基线减轻达14.7%。值得一提的是,在试验第一周时便观察到接受皮下剂型患者显著的体重减轻效果,近100%患者在停药4周后其体重减轻的大部分效果仍然维持。目前该公司正在规划VK2735注射剂型的3期研究,以及口服剂型的2期研究。
(3)OSE Immunotherapeutics在研抗体疗法lusvertikimab的2期临床结果积极,针对溃疡性结肠炎
11月5日,OSE Immunotherapeutics公布了在研抗体疗法lusvertikimab(OSE-127)在随机双盲、安慰剂对照的2期临床试验CoTikiS中的诱导治疗期积极结果,显示其在中度至重度活动性溃疡性结肠炎(UC)患者中具有显著疗效和良好的安全性。数据显示,Lusvertikimab在第10周达到了主要疗效终点,即UC疾病活动指数评分MMS的改善。数据显示,在850 mg剂量组,lusvertikimab与安慰剂相比,评分差异为-0.9分(p=0.036);在450 mg组:lusvertikimab与安慰剂相比差异为-1.16分(p=0.019)。合并450 mg和850 mg组,lusvertikimab与安慰剂相比差异为-1.00分(p=0.010)。
(4)Kite/Arcellx联合开发的创新CAR-T疗法亮眼结果公布,治疗多发性骨髓瘤
11月6日,吉利德(Gilead)旗下Kite公司与Arcellx宣布将在今年的美国血液学会(ASH)年会当中,公布其联合开发BCMA靶向CAR-T细胞疗法anitocabtagene autoleucel(anito-cel)用于治疗复发或难治性多发性骨髓瘤(RRMM)患者的临床试验最新结果。数据显示,所有患者产生临床应答,总缓解率为100%,CR/sCR率为79%(30/38),5名患者达到非常好的部分缓解(≥VGPR率为92%),3名患者达到部分缓解。相关临床3期研究iMMagine-3已于2024年下半年启动,并已完成了首例患者给药。
(5)Beam Therapeutics在研碱基编辑疗法临床1/2期初步结果积极,针对镰状细胞病
11月6日,Beam Therapeutics宣布将在美国血液学会(ASH)年会当中公布其在研碱基编辑疗法BEAM-101在BEACON临床1/2期试验当中治疗镰状细胞病(SCD)患者的初步积极结果。分析显示,所有接受至少一个月随访的4名患者在中位17天(15–19天)和20天(11–34天)内分别达到了中性粒细胞和血小板植入。所有患者在第1个月内均迅速且显著地诱导了HbF的生成(>60%),并相应地降低了未输血血液中的镰状血红蛋白(HbS)水平(≤36%),且这一效果持续维持。此外,溶血标志物在所有4名患者中均已正常化或有所改善。Beam的试验目标是将HbF水平提高到至少60%,同时将HbS降至40%或更低。目前的患者队列规模较小,随访时间有限,但Beam公司已成功达到其预定试验目标。
(6)强生抗CD38抗体Darzalex达3期临床主要终点,针对多发性骨髓瘤
11月6日,美国血液学会(ASH)公布了2024年会上部分研究的摘要,强生(Johnson & Johnson)公司开发的抗CD38抗体Darzalex(daratumumab)在名为Aquila的3期临床试验中达到主要终点,显著延缓高风险冒烟性多发性骨髓瘤(SMM)患者的疾病进展。摘要数据显示,在中位随访时间65.2个月时,与积极监测相比,Darzalex显著改善了患者的无进展生存期(PFS,HR=0.49;95% CI,0.36-0.67;P<0.0001)。Darzalex组的中位PFS尚未达到,而积极监测组为41.5个月;预计60个月的无进展生存率分别为63.1%和40.8%。预设分析显示,Darzalex组的客观缓解率(ORR)为63.4%,而积极监测组仅为2.0%(P<0.0001)。截至数据截止日期,Darzalex组有64人(33.0%),主动监测组有102人(52.0%)已开始一线MM治疗。
(7)Arcus Biosciences在研TIGIT单抗domvanalimab最新临床结果发布,治疗非小细胞肺癌
11月6日,Arcus Biosciences公司公布了在研抗TIGIT单克隆抗体domvanalimab与抗PD-1单克隆抗体zimberelimab联用(DZ组合),治疗PD-L1高表达的局部晚期或转移性非小细胞肺癌(NSCLC)患者的3期临床试验ARC-10第一部分的结果。数据显示,DZ组合与zimberelimab单药治疗或化疗相比,患者无进展生存期、总生存期和客观缓解率均更高。与zimberelimab单药治疗相比,DZ组合疗法将患者的死亡风险降低36%(HR=0.64)。Zimberelimab单药治疗组的中位总生存期为24.4个月,DZ组合治疗组患者的中位总生存期尚未达到。
(8)Tango Therapeutics潜在“best-in-class”合成致死疗法早期临床结果积极
11月7日,Tango Therapeutics公司宣布,基于在研疗法TNG462在1/2期临床试验剂量递增和早期剂量扩展队列中获得的积极数据,该公司已选择TNG462进入全面开发。TNG462是一款基于合成致死理念设计的精准抗癌疗法。数据显示,TNG462在多种肿瘤类型中展现了抗癌活性且耐受性良好,包括非小细胞肺癌(NSCLC)和胰腺癌。多种肿瘤类型的肿瘤体积随着持续治疗而缩小,约60%最初被评估为疾病稳定的患者在之后出现部分缓解。尽管目前大多数癌症类型的患者数和随访时间不足以准确估算客观缓解率(ORR),但在已入组的7名胆管癌患者中,观察到其中3名患者获得确认缓解(ORR=43%)。4名胆管癌患者仍在治疗中,中位治疗时间为24周,并仍在增加。
(9)阿斯利康CD19 x CD3靶向双特异性T细胞接合器亮眼数据公布,针对滤泡性淋巴瘤
11月8日,阿斯利康宣布在今年的美国血液学会(ASH)年会当中,公布旗下多款血液学管线的临床结果。该公司的下一代T细胞接合器AZD0486用于复发/难治性滤泡性淋巴瘤(R/R FL)患者治疗时展现高达96%的总缓解率。临床1期试验结果显示,R/R FL患者对2.4毫克及以上剂量的AZD0486高度应答,患者的总缓解率高达96%,完全缓解率达85%,且患者的最小残留病灶(MRD)阴性比率很高。此外,1期试验中期结果也显示,接受过大量治疗的弥漫大B细胞淋巴瘤(DLBCL)患者也对AZD0486高度应答,患者的CR率高。最新数据还显示AZD0486具有良好的安全性,双倍递增给药方案可有效缓解患者发生细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)事件。
(10)ImPact Biotech在研帕利泊芬血管靶向光动力疗法3期试验积极结果公布
11月8日,ImPact Biotech公司宣布了ENLIGHTED临床3期试验的最新中期结果。帕利泊芬VTP疗法是一种选择性消融不可切除实体瘤的微创药物-医疗器械组合疗法。该新型VTP平台通过光纤传递非热激光光源,在肿瘤微环境中局部激活帕利泊芬。ENLIGHTED研究是一项单一队列、非随机、开放标签的3期关键试验,旨在评估帕利泊芬VTP用于治疗低级别UTUC患者的疗效与安全性,分析显示,在14名可评估疗效的患者中,有12名(86%)在ITP结束时达到了CR。
同期事件:
1. 2024年第45周11.04-11.10国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第45周11.04-11.10国内仿制药/生物类似物申报/审批数据分析
3. 2024年第45周11.04-11.10国内医药大健康行业政策法规汇总
4. 2024年第45周11.04-11.10全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.11.04-2024.11.10)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论