

案例概述
案例相关问题调研
病例展示
病例展示

病理检查

一线治疗
2024年2月行白蛋白紫杉醇+卡培他滨方案化疗4周期,疗效稳定。
后应用白蛋白紫杉醇+免疫治疗1周期,肿物较前增大。
晚期二线治疗:2024年8月7日行T-DXd治疗。

专家点评
TNBC被定义为为缺乏雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)的乳腺癌亚型[1],约占乳腺癌的10%~20%,通常发生在年轻女性中,是最具侵袭性且预后较差的乳腺癌亚型[2-3]。其中,约30%的TNBC患者为HER2低表达[4]。
目前,对于HER2低表达TNBC患者,根据CSCO、CACA-CBCS、ESMO等国内外权威指南,应先按照TNBC治疗,推荐化疗或化疗联合免疫治疗为一线治疗方案[5-7]。本案例患者初诊为HER2低表达晚期TNBC,晚期一线接受白蛋白紫杉醇+卡培他滨,后接受白蛋白紫杉醇+免疫治疗,符合当时的证据支持和临床实践。
一项回顾性分析研究结果显示,HER2低表达TNBC相比HER2零表达TNBC存在异质性,应施以针对性精准治疗[8]。CACA-CBCS、CSCO、《中国晚期三阴性乳腺癌临床诊疗指南(2024版)》、NCCN等国内外权威指南中均指出对于晚期三阴性乳腺癌患者的治疗需进行精准的靶向治疗,可选择ADC药物[5,6,9,10]。T-DXd作为新型ADC药物可精准杀伤肿瘤细胞,发挥强效的抗肿瘤活性。同时,T-DXd也是我国首个获批针对于HER2低表达晚期乳腺癌适应症的二线标准靶向药物。
DESTINY-Breast04(DB04)研究是首个针对HER2低表达转移性乳腺癌患者并取得阳性结果的III期临床试验。研究中纳入58例HER2低表达TNBC患者,这类患者均接受过≥1线化疗。ASCO大会上公布的研究结果显示[11],TNBC队列中,T-DXd组的中位无进展生存期(PFS)较化疗组延长5.6个月(8.5个月 vs 2.9个月,95%CI 4.3-11.7,HR=0.46);T-DXd组的中位总生存期(OS)较化疗组延长9.9个月(18.2个月 vs 8.3个月,95%CI 13.6-NE,HR=0.48),并且T-DXd组的客观缓解率(ORR)达50.0%,是化疗组16.7%的近三倍。不仅如此,T-DXd组的中位持续缓解时间(DoR)为8.6个月,长于化疗组的4.9个月,T-DXd组和化疗组的中位至肿瘤缓解时间(TTR)分别为1.51个月和1.41个月。在DB04研究中,T-DXd在HER2低表达TNBC患者中展现出与总人群一致的获益,PFS、OS、ORR及DoR均优于化疗,并且T-DXd的起效时间与化疗一样迅速。

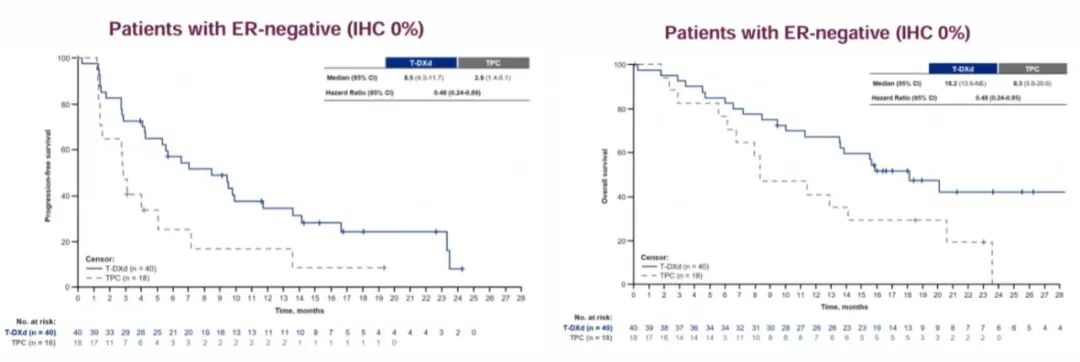
图1. DESTINY-Breast04研究中TNBC亚组的PFS、OS数据
表1. DESTINY-Breast04研究的肿瘤缓解相关数据


基于此项研究结果,美国食品药品监督管理局(FDA)和中国国家药品监督管理局(NMPA)均已批准T-DXd用于HER2低表达晚期乳腺癌治疗的相关适应症。同时,NCCN、ESMO、CSCO、CACA-CBCS等国内外权威指南一致推荐T-DXd作为一线治疗失败的HER2低表达TNBC的≥2线首选治疗方案[4-6,10]。

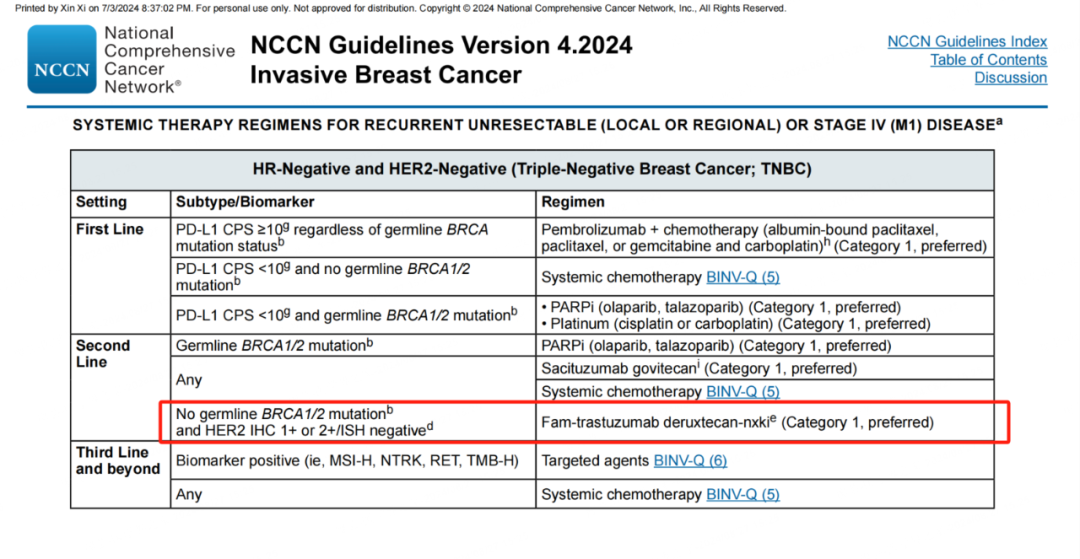
图2. 2024 NCCN V4版指南中对HER2低表达TNBC患者的推荐治疗

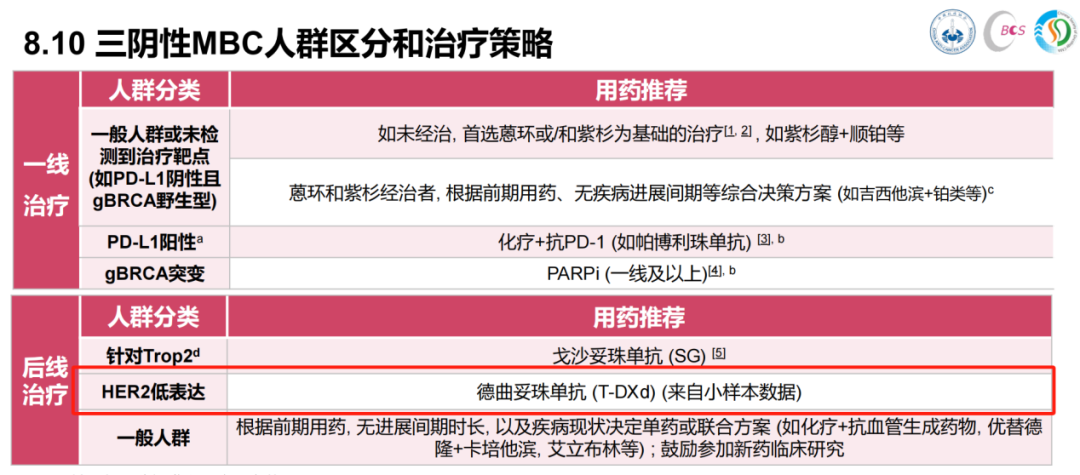
图3. 2024版CACA-CBCS指南中对HER2低表达TNBC患者的推荐治疗
结合本案例患者在一线化疗联合免疫治疗后疾病进展,后续接受T-DXd是正确的选择,从真实世界实践角度说明了在HER2低表达TNBC患者一线治疗失败后选用T-DXd的重要性,为临床应用提供了更多有效依据,期待后续T-DXd为本案例患者带来更大获益。展望未来,随着精准医疗理念的深入发展和生物学技术的不断进步,更多的临床数据和药物治疗方案将为更多TNBC患者带来希望。
专家介绍
王笑新 教授
辽宁省肿瘤医院
中国老年学和老年医学学会肿瘤康复分会委员
中国研究型医院学会精准医学与肿瘤MDT专业委员会委员
辽宁省生命科学学会老年肿瘤专业委员会常委
辽宁省生命科学学会乳腺癌诊治与康复专业委员会常委
擅长乳腺癌的诊治及个体化治疗,合理运用各种靶向治疗及内分泌治疗,对晚期乳腺癌的维持治疗有丰富的经验;在肺癌的诊断、分子靶向治疗、化疗以及肺癌的各种急症处理等方面也有丰富的临床经验;在胃肠道恶性肿瘤及恶性淋巴瘤等恶性肿瘤的诊治及治疗上有大量成功病例;同时对疑难病例也有丰富诊治经验

ADC Academy Online
ADC Academy Online是聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论