
时光匆匆,年末将至。随着2023年即将结束,医药行业也进入了最后的冲刺阶段。据药融云《全球在研新药与靶点月报》数据统计,在2023年11月,共有145个化药1类新药受理号获CDE承办(含补充申请30个),其中国产92个,进口23个,从申请类型来看,包括临床申请107个,上市申请8个,涉及75个品种,78家企业。
11月共有103个1类治疗用生物制品受理号获CDE承办(含补充申请23个),其中国产64个,进口16个,从申请类型来看,包括临床申请79个,上市申请1个,涉及79个品种,79家企业。
同时,有5个1类中药受理号获CDE承办(含补充申请1个),其中国产4个,进口0个,从申请类型来看,包括临床申请3个,上市申请1个,涉及5个品种,6家企业。
11月共有125款新药获批临床(共计217个受理号),其中包括66款化药,56款生物制品,3款中药;还有6款新药获批上市。
2023 年 11 月国内获批临床新药一览表(部分)
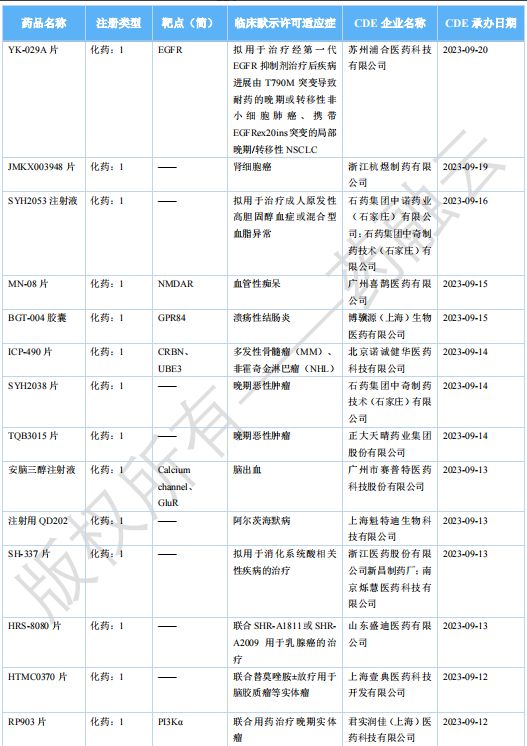
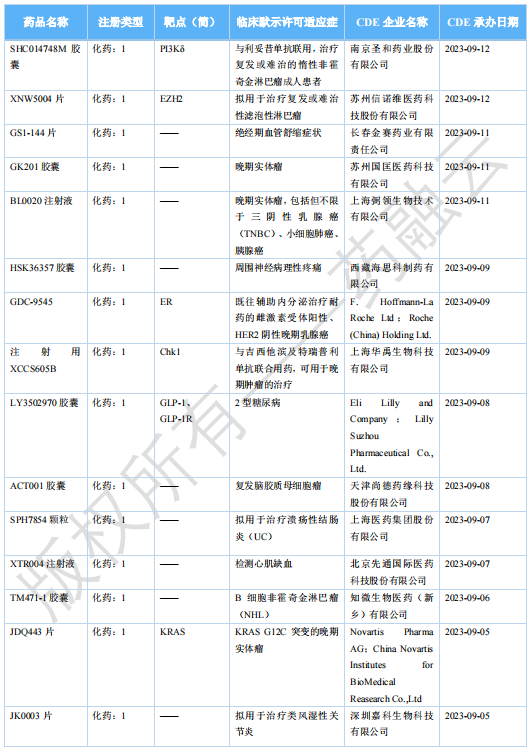
图片来源:药融云《全球在研新药与靶点月报》
1.罗氏CD3/CD20双抗「格菲妥单抗」在华获批上市
11月8日,国家药品监督管理局发布监管动态,附条件批准RochePharma(Schweiz)AG的格菲妥单抗注射液(商品名:高罗华/Columvi)上市,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(R/R DLBCL)成人患者。如适用应将本品与秋水仙碱联合使用。
格菲妥单抗注射液是一种双特异性抗体,也是全球首个且目前唯一对R/R DLBCL患者进行固定周期治疗的双特异性抗体,在国内获批标志着中国淋巴瘤治疗正式进入“双抗新时代”。其通过与B细胞表面的CD20和T细胞表面的CD3同时结合,介导免疫突触形成,随后引起T细胞活化与增殖、细胞因子分泌和细胞溶解蛋白释放,从而诱导表达CD20的B细胞溶解。
2.合源生物CAR-T产品「纳基奥仑赛」获NMPA批准上市,治疗白血病
11月8日,国家药品监督管理局发布监管动态,附条件批准合源生物科技(天津)有限公司申报的纳基奥仑赛注射液(商品名:源瑞达)上市,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病。这是首款在中国获批上市的治疗白血病的CAR-T产品。
纳基奥仑赛注射液是通过基因修饰技术将靶向CD19的嵌合抗原受体(CAR)表达于T细胞表面而制备成的自体T细胞免疫治疗产品。输注至体内后会与表达CD19的靶细胞结合,激活下游信号通路,诱导CAR-T细胞的活化和增殖并产生对靶细胞的杀伤作用。
纳基奥仑赛注射液-获批生产审评耗时335天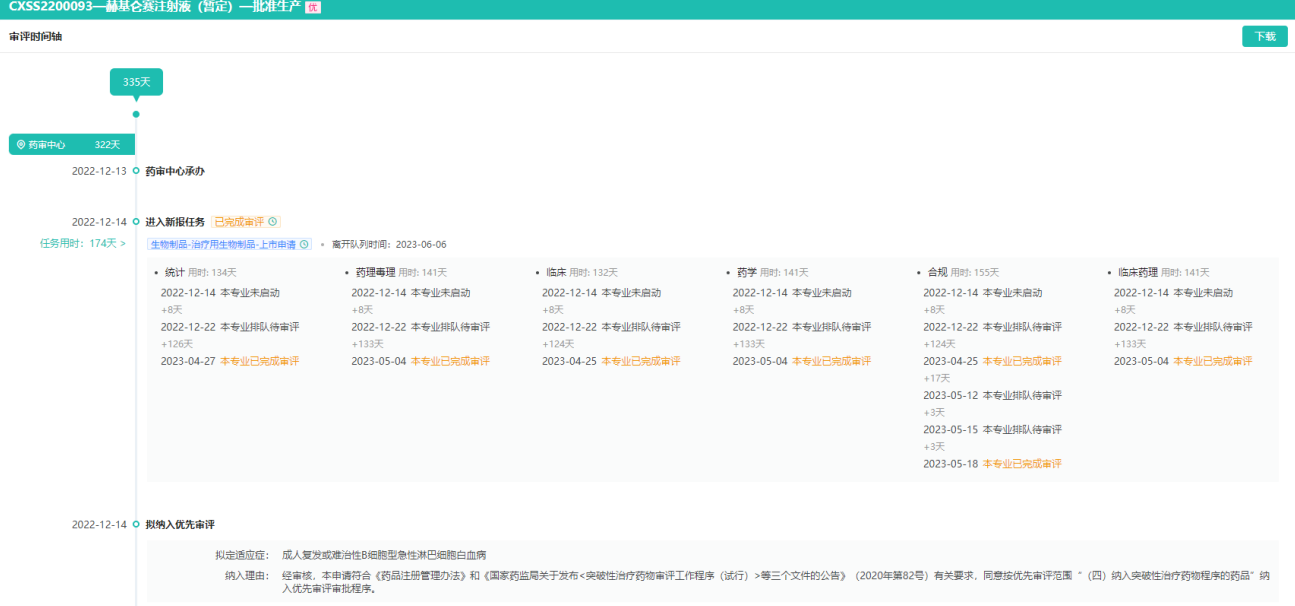

图片来源:药融云中国药品审评数据库
药融云数据库显示,纳基奥仑赛注射液先后获得国家药品监督管理局3项新药临床试验(IND)许可,用于治疗成人复发或难治性急性淋巴细胞白血病、治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童及青少年复发或难治B细胞型急性淋巴细胞白血病。今年3月,美国FDA也已批准纳基奥仑赛注射液的IND申请,拟开发用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/rB-ALL)。
3. 海特生物注射用重组变构人肿瘤坏死因子相关凋亡诱导配体获NMPA批准上市
11月8日,国家药品监督管理局批准海特生物注射用重组变构人肿瘤坏死因子相关凋亡诱导配体上市,联合沙利度胺和地塞米松用于既往接受过至少2种系统性治疗方案的复发或难治性多发性骨髓瘤成人患者。
注射用重组变构人肿瘤坏死因子相关凋亡诱导配体是重组变构人肿瘤坏死因子相关凋亡诱导配体,可结合并激活肿瘤细胞表面的死亡受体4(DR4)/死亡受体5(DR5),通过外源性细胞凋亡途径触发细胞内Caspase级联反应,从而发挥抗肿瘤作用。
4. 天然药物创新药香雷糖足膏上市
11月14日,国家药品监督管理局发布监管动态,附条件批准合一生技股份有限公司申报的天然药物1.1类创新药香雷糖足膏(研发代号:ON101,速必一,Fespixon)上市,用于清创后创面截面积小于25cm2的Wagner1级糖尿病足部伤口溃疡(DFU)。
DFU是糖尿病患者致残和致死的主要原因之一,由于缺乏足够的医疗资源和有效的药物,导致疾病预后效果很差,临床病死率和致残率甚至比大多数癌症都要高。85%以上的糖尿病患者截肢起因于DFU,给患者和社会均带来了较为严重的治疗和经济负担。该病被看作是糖尿病领域最急迫解决的未满足需求之一。糖尿病足溃疡的新药研发一直以来也是医药界的难题,目前全球在研的新药寥寥无几,供需严重失衡。
ON101全球研发现状

图片来源:药融云全球药物研发数据库
据相关市场调查报告显示,糖尿病足溃疡的全球市场规模在2017年为36亿美元,且于2019年至2025年间将以每年8.2%的速度增长。2021年全球糖尿病足溃疡治疗市场规模达到302.31亿元。鉴于糖尿病足庞大的市场份额,近年来多家企业在该领域达成合作,包括翰森制药、中国生物制药、三生制药、海和医药、海思科等传统药企。
5. NMPA附条件批准鞍石生物「伯瑞替尼肠溶胶囊」上市
11月16日,国家药品监督管理局宣布,附条件批准北京浦润奥生物科技有限责任公司(以下简称“浦润奥生物”)申报的1类创新药伯瑞替尼肠溶胶囊上市。该药适用于治疗具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌患者。
伯瑞替尼(PLB1001,vebreltinib)是一款小分子高选择性MET激酶抑制剂,能够透过血脑屏障,阻断ZM融合基因下游信号通路,达到抑制肿瘤生长和侵袭的作用。该产品在多种临床前MET异常的人类胃癌、肝癌、胰腺癌和肺癌细胞移植动物模型(CDX)和人源肿瘤移植小鼠模型(PDX)中显示出良好的抑制肿瘤作用。
伯瑞替尼作用机制及适应症
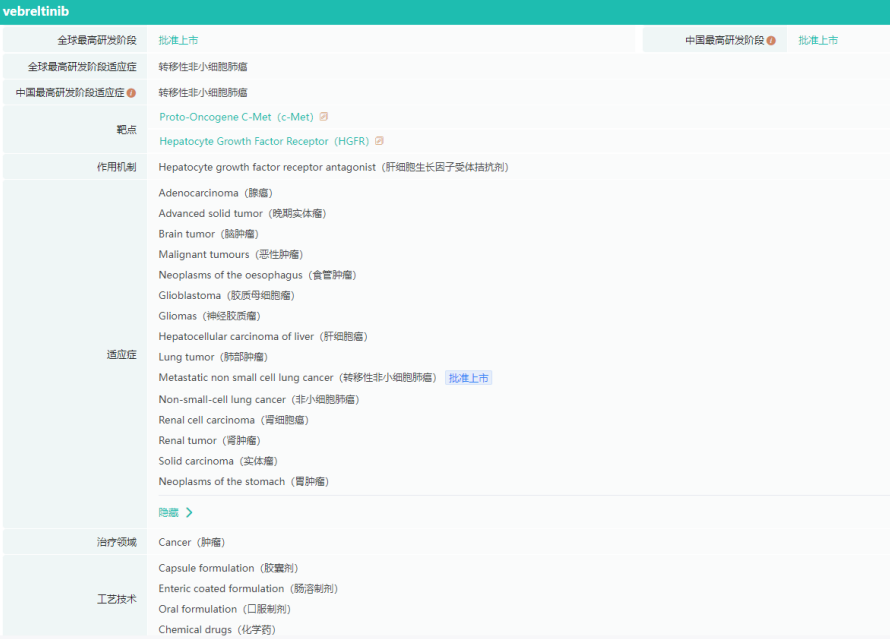

图片来源:药融云全球药物研发数据库
伯瑞替尼肠溶胶囊在中国的开发权由浦润奥生物拥有。2021年12月,鞍石生物宣布完成对浦润奥生物的收购,从而将伯瑞替尼纳入了其研发管线。在中国大陆、香港及澳门地区以外的其它地区,伯瑞替尼的开发权益归冠科美博(Apollomics)所有。
6. 住友制药拉法姆林片和拉法姆林注射液获NMPA批准上市
11月17日,国家药品监督管理局发布批准证明文件,批准住友制药的拉法姆林片和拉法姆林注射液上市,用于治疗社区获得性细菌性肺炎(CABP)。
拉法姆林是一种创新截短侧耳素(pleuromutilin)类抗生素,可以通过静脉注射或者口服给药。通过与细菌核糖体的肽基转移酶中心(PTC)相结合,它能够抑制细菌的蛋白合成,从而达到抑制细菌生长的效果。此外,lefamulin能够有效地靶向造成呼吸道疾病的病原体(包括多重耐药性菌株),同时细菌不容易对它产生抗性,而且不会因为它而产生对其它类型抗生素的抗性,目前已在美国、欧盟等地上市。
<END>
想要获取药融云《全球在研新药与靶点月报》全部报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往“药融云”数据库进行查询。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论