1.4.1本周全球TOP10创新药研发进展
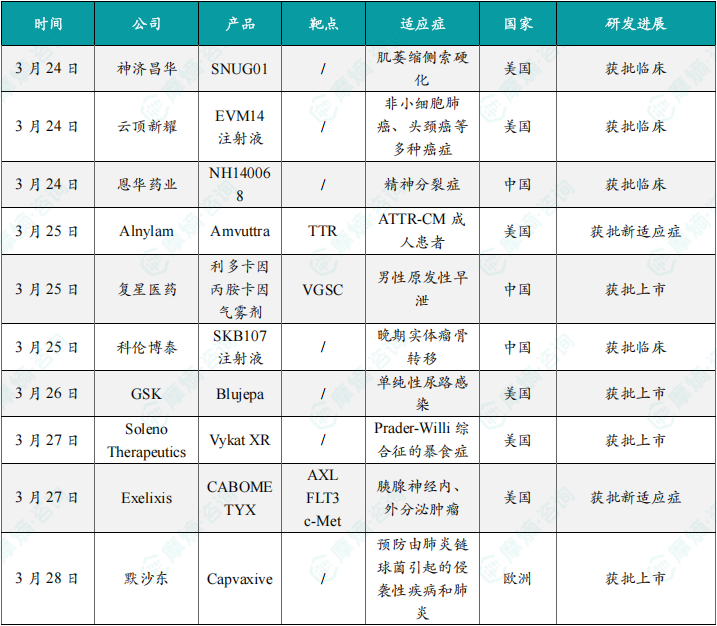
(1)神济昌华SNUG01在美国获批临床,用于治疗肌萎缩侧索硬化
3月24日,神济昌华宣布其创新药物SNUG01在美国获批临床,拟用于治疗肌萎缩侧索硬化(ALS)。ALS是一种致命的神经退行性疾病,目前全球尚无根治手段。SNUG01作为基因疗法,靶向与疾病相关的SOD1基因突变,通过腺相关病毒(AAV)载体递送基因编辑工具,旨在修复或抑制突变基因的表达,从而延缓运动神经元退化。此前,该药物在临床前研究中已展现显著疗效,能够延长模型动物的生存期并改善运动功能。此次获批临床标志着神济昌华在神经退行性疾病领域迈出重要一步,未来将开展针对ALS患者的1期安全性及有效性试验。
(2)云顶新耀EVM14注射液在美国获批临床,用于治疗非小细胞肺癌、头颈癌等多种癌症
3月24日,云顶新耀的EVM14注射液在美国获批进入临床阶段,适应症涵盖非小细胞肺癌(NSCLC)及头颈癌等多种实体瘤。公开资料显示,EVM14是一款靶向Claudin 18.2的抗体偶联药物(ADC),通过精准识别肿瘤细胞表面抗原并释放化疗药物,实现高效杀伤癌细胞。在临床前模型中,EVM14对Claudin 18.2高表达的肿瘤展现出显著抑制效果,且安全性良好。此次I期试验将评估其在晚期癌症患者中的耐受性与抗肿瘤活性。云顶新耀计划通过中美双报策略加速开发,目标是为阳性肿瘤患者提供新一代精准治疗方案。
(3)恩华药业NH140068在中国获批临床,用于治疗精神分裂症
3月24日,恩华药业宣布其1类新药NH140068在中国获得临床试验批准,适应症为精神分裂症。根据公司公告,NH140068是一种新型谷氨酸能调节剂,通过激活代谢型谷氨酸受体(mGluR2/3),改善精神分裂症患者的阳性症状(如幻觉)和阴性症状(如情感迟钝)。临床前数据显示,该药物在动物模型中表现出优于传统抗精神病药物的疗效,且无明显锥体外系反应。此次I期试验将重点评估其在中国人群中的药代动力学特征与安全性。若后续试验成功,NH140068有望填补国内精神分裂症治疗领域对新型机制药物的需求。
(4)Alnylam RNAi疗法Amvuttra在美国获批新适应症,用于治疗ATTR-CM成人患者
3月25日,Alnylam Pharmaceuticals的RNAi疗法Amvuttra(vutrisiran)获FDA批准扩展适应症,用于治疗转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)。ATTR-CM是一种由异常淀粉样蛋白沉积引发的心脏疾病,传统治疗仅能缓解症状。Amvuttra通过靶向肝脏中TTR mRNA,从源头抑制致病蛋白生成。在HELIOS-B III期试验中,患者接受Amvuttra治疗12个月后,心脏淀粉样蛋白负荷显著降低,心血管事件风险减少62%。此次获批使Amvuttra成为首个针对ATTR-CM的RNAi药物,进一步巩固其在淀粉样变性治疗领域的领先地位。
(5)复星医药利多卡因丙胺卡因气雾剂在中国获批上市,用于治疗男性原发性早泄
3月25日,复星医药的利多卡因丙胺卡因气雾剂在中国获批上市,适应症为男性原发性早泄。该产品为局部麻醉剂复方制剂,通过快速作用于阴茎敏感神经末梢,降低性刺激传导速度,从而延长射精潜伏时间。相比传统口服药物,其起效快、全身副作用少,且使用便捷。获批基于一项多中心3期临床试验,结果显示患者平均射精时间延长至3分钟以上,满意度达85%。该产品的上市填补了国内外用早泄治疗药物的市场空白。
(6)科伦博泰SKB107注射液在中国获批临床,用于治疗晚期实体瘤骨转移
3月25日,科伦博泰的SKB107注射液在中国获批临床,拟用于晚期实体瘤骨转移治疗。SKB107是一种靶向RANKL的单克隆抗体,通过抑制破骨细胞活性,减少骨破坏和疼痛。临床前研究显示,其骨保护效果与已上市药物相当,且半衰期更长,有望减少给药频率。科伦博泰计划在1期试验中评估其安全性与药效动力学,未来或与免疫疗法联用,探索协同抗肿瘤潜力。
(7)GSK新型抗生素Blujepa在美国获批上市,用于治疗单纯性尿路感染
3月26日,葛兰素史克(GSK)宣布其新型抗生素Blujepa(gepotidacin)在美国获批上市,用于治疗单纯性尿路感染(UTI)。Blujepa属于三氮杂苄类抗生素,通过抑制细菌DNA旋转酶和拓扑异构酶IV,对多重耐药菌(如大肠杆菌)具有强效杀菌活性。3期临床试验显示,其疗效与现行标准疗法相当,且耐药风险更低。此次获批为耐药性UTI患者提供了亟需的新选择,尤其在全球抗生素耐药加剧的背景下意义显著。
(8)Soleno公司的Vykat XR在美国获批上市,用于治疗Prader-Willi综合征暴食症
3月27日,Soleno Therapeutics的Vykat XR缓释片在美国获批上市,适应症为Prader-Willi综合征(PWS)相关的暴食症。Vykat XR通过调节下丘脑食欲调控通路,减少患者无法控制的饥饿感和过度摄食行为。关键3期试验表明,治疗组患者日均摄食量减少40%,且安全性良好。作为首个针对PWS暴食症的获批药物,Vykat XR有望显著改善患者生活质量,降低肥胖及相关并发症风险。
(9)Exelixis多靶点酪氨酸激酶抑制剂在美国获批新适应症,用于治疗胰腺神经内、外分泌肿瘤
3月27日,Exelixis的多靶点酪氨酸激酶抑制剂Cabozantinib(商品名Cometriq)获FDA批准扩展适应症,用于晚期胰腺神经内分泌肿瘤(pNET)。在III期CABINET试验中,该药显著延长患者无进展生存期(PFS)至16.6个月,较安慰剂组提升11.2个月。其通过抑制VEGFR、MET等肿瘤血管生成与转移相关靶点发挥作用。此次获批使Cabozantinib成为首个覆盖pNET一线治疗的口服药物,预计2025年新增适应症将贡献超2亿美元销售额。
(10)默沙东Capvaxive在欧盟获批上市,用于预防由肺炎链球菌引起的侵袭性疾病和肺炎
3月28日,默沙东的新型肺炎疫苗Capvaxive(20价肺炎球菌结合疫苗)获欧洲药品管理局(EMA)批准上市,用于预防由肺炎链球菌引起的侵袭性疾病和肺炎。与传统13价疫苗相比,Capvaxive新增覆盖7种高致病性血清型(如3型、22F型),免疫原性提升35%。在III期临床中,其对65岁以上老年人群的保护效力达90%以上。默沙东计划将其纳入欧盟老年人肺炎疫苗接种计划,预计2026年市场份额将超越辉瑞的Prevnar 20。
1.4.2本周全球TOP10积极/失败临床结果
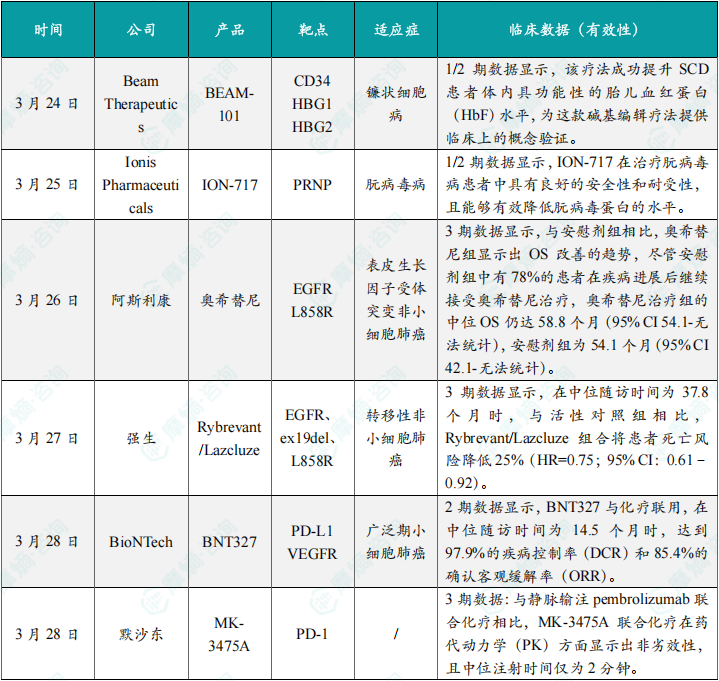
(1)Beam公司碱基编辑疗法BEA M-101在镰状细胞病1/2期临床中展现潜力
3月24日,Beam Therapeutics公布了其碱基编辑疗法BEA M-101针对镰状细胞病(SCD)的1/2期临床试验积极数据。BEA M-101通过单碱基编辑技术精准修饰患者造血干细胞中的特定基因位点,旨在重新激活胎儿血红蛋白(Hb F)的表达。Hb F可替代异常血红蛋白,缓解SCD患者的红细胞镰状化和溶血问题。数据显示,接受治疗的患者体内功能性Hb F水平显著提升,且未报告严重不良反应。此次结果首次验证了碱基编辑技术在此类遗传病中的临床可行性,为后续开发提供了关键概念验证。Beam计划进一步扩大样本量以确认疗效和安全性。
(2)Ionis公司反义寡核苷酸ION-717在朊病毒病1/2期试验中安全性良好
3月25日,Ionis Pharmaceuticals宣布其反义寡核苷酸疗法ION-717在治疗朊病毒病的1/2期临床试验中取得积极进展。ION-717靶向朊病毒蛋白(PrP)的mRNA,通过减少PrP的生成来延缓疾病进展。朊病毒病是一种罕见且致命的神经退行性疾病,目前尚无有效疗法。数据显示,ION-717在患者中表现出良好的安全性和耐受性,并显著降低了脑脊液中的PrP水平。尽管疗效终点尚未完全解锁,但早期数据已为该疗法的机制提供了支持。Ionis计划推进更高剂量组的研究,并探索与其他疗法的联合应用。
(3)阿斯利康奥希替尼3期试验显示EGFR突变非小细胞肺癌OS改善趋势
3月26日,阿斯利康公布了第三代EGFR-TKI奥希替尼(泰瑞沙)在表皮生长因子受体(EGFR)突变非小细胞肺癌(NSCLC)患者中的3期临床试验结果。与安慰剂组相比,奥希替尼组中位总生存期(OS)达58.8个月(95% CI 54.1-NR)),而安慰剂组为54.1个月(95% CI 42.1-NR)。值得注意的是,78%的安慰剂组患者在疾病进展后交叉接受了奥希替尼治疗,可能稀释了两组差异。尽管如此,奥希替尼仍展现出明确的生存获益,巩固了其作为EGFR突变晚期NSCLC一线治疗的标准地位。该数据进一步支持了早期使用奥希替尼的临床策略。
(4)强生Rybrevant/Lazcluze组合在EGFR ex19del/L858R突变肺癌3期试验中死亡风险降低25%
3月27日,强生宣布其EGFR/MET双特异性抗体Rybrevant(Amivantamab)联合第三代TKI Lazcluze(Lazertinib)在EGFR ex19del或L858R突变转移性NSCLC的3期试验中达到主要终点。中位随访37.8个月时,联合组患者死亡风险较活性对照组降低25%(HR=0.75,95% CI 0.61-0.92)。该组合通过同时抑制EGFR和MET信号通路,克服了传统TKI的耐药问题。此外,Rybrevant的皮下制剂可将注射时间缩短至2分钟,显著提升治疗便捷性。该结果有望推动该组合成为EGFR突变肺癌的二线治疗新标准。
(5)BioNTech双抗BNT327联合化疗在小细胞肺癌2期试验中DCR达97.9%
3月28日,BioNTech公布了其双特异性抗体BNT327联合化疗治疗广泛期小细胞肺癌(ES-SCLC)的2期试验数据。BNT327靶向肿瘤细胞表面的DLL3和CD3,通过激活T细胞介导肿瘤杀伤。中位随访14.5个月时,联合治疗的疾病控制率(DCR)达97.9%,确认客观缓解率(ORR)为85.4%,远超传统化疗(ORR约60%-70%)。该疗法还表现出可控的安全性,未出现新的免疫相关不良反应。BioNTech计划启动3期试验,进一步验证其在ES-SCLC一线治疗中的潜力。
(6)默沙东皮下制剂MK-3475A在3期试验中实现非劣效PK与快速给药
3月28日,默沙东宣布其皮下注射PD-1抑制剂MK-3475A(含pembrolizumab)联合化疗的3期试验达到主要终点。与静脉输注pembrolizumab相比,MK-3475A在药代动力学(PK)参数上显示非劣效性,且中位注射时间仅需2分钟(静脉输注需30分钟以上)。这一改进显著提升了治疗便捷性,尤其适用于门诊患者。尽管疗效数据尚未披露,但其PK优势已为皮下制剂的广泛应用奠定了基础。默沙东计划向监管机构提交上市申请,进一步拓展pembrolizumab的给药形式。
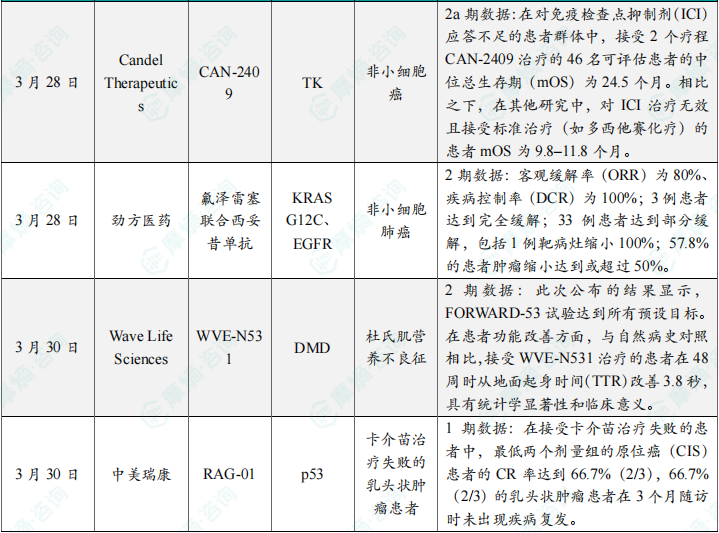
(7)Candel公司溶瘤病毒CAN-2409在ICI耐药肺癌2a期试验中延长生存期
3月28日,Candel Therapeutics公布了溶瘤病毒疗法CAN-2409在免疫检查点抑制剂(ICI)耐药非小细胞肺癌患者的2a期数据。接受两个疗程治疗的46例患者中位总生存期(mOS)达24.5个月,而基线ICI治疗进展患者的mOS为21.5个月,显著优于历史对照(标准治疗mOS为9.8-11.8个月)。CAN-2409通过诱导局部免疫激活和全身抗肿瘤免疫应答,逆转了ICI耐药。公司计划启动关键性试验,探索其与ICI联用的协同效应。
(8)劲方医药氟泽雷塞联合西妥昔单抗在非小细胞肺癌2期试验中ORR达80%
3月28日,劲方医药公布了EGFR exon20插入突变NSCLC患者接受氟泽雷塞(新型EGFR抑制剂)联合西妥昔单抗的2期数据。客观缓解率(ORR)达80%,疾病控制率(DCR)为100%,其中3例完全缓解(CR),33例部分缓解(PR),57.8%的患者肿瘤缩小≥50%。该组合通过双重阻断EGFR信号通路,克服了exon20插入突变对传统TKI的耐药性。劲方计划与美国FDA沟通加速批准路径,有望填补该突变亚型的治疗空白。
(9)Wave Life Sciences反义疗法WVE-N531在杜氏肌营养不良2期试验中改善患者功能
3月30日,Wave Life Sciences公布了反义寡核苷酸WVE-N531治疗杜氏肌营养不良(DMD)的2期FORWARD-53试验结果。接受治疗的患者在48周时从地面起身时间(TTR)较自然病史组缩短3.8秒(p<0.01),达到统计学和临床双重显著性。WVE-N531通过跳过外显子53恢复抗肌萎缩蛋白表达,适用于约8%的DMD患者。该数据支持其进入关键试验,有望成为首个针对外显子53跳跃的DMD疗法。
(10)中美瑞康RAG-01在卡介苗失败膀胱癌1期试验中CR率达66.7%
3月30日,中美瑞康公布了其基因疗法RAG-01在卡介苗(BCG)治疗失败的非肌层浸润性膀胱癌(NMIBC)患者的1期数据。最低两个剂量组的原位癌(CIS)患者完全缓解率(CR)达66.7%(2/3),66.7%的乳头状肿瘤患者在3个月随访时未复发。RAG-01通过腺病毒载体递送免疫刺激基因,激活局部抗肿瘤免疫应答。公司计划扩展队列以确认疗效,并探索其作为BCG耐药患者挽救性疗法的潜力。
同期事件:
1. 2025年第13周03.24-03.30国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第13周03.24-03.30国内仿制药/生物类似物申报/审批数据分析
3. 2025年第13周03.24-03.30国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.24-2025.03.30)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论