1.4.1本周全球TOP10创新药研发进展
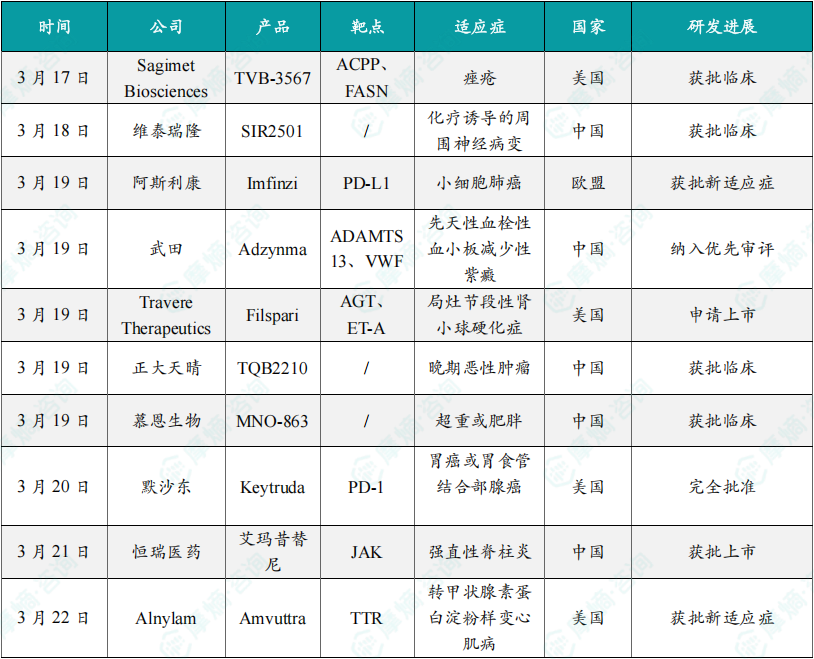
(1)Sagimet公司脂肪酸合成酶抑制剂TVB-3567在美国获批临床,用于治疗痤疮
3月17日,Sagimet Biosciences公司宣布,其用于治疗痤疮的脂肪酸合成酶(FASN)抑制剂TVB-3567的IND申请已获得批准。TVB-3567是一种强效的选择性小分子FASN抑制剂,计划于2025年开始首次人体1期临床试验。痤疮的发生与皮肤中皮脂分泌增加密切相关。FASN是从头脂肪生成途径中的最后一步,该途径产生约80%的皮脂脂质。先前的临床前和临床研究表明,FASN抑制剂可以改善皮脂成分并显著减少痤疮病变,有潜力作为治疗痤疮的靶点。
(2)维泰瑞隆1类新药SIR2501在中国获批临床,拟用于治疗化疗诱导的周围神经病变
3月18日,中国国家药监局药品审评中心官网公示,维泰瑞隆申报的1类新药SIR2501片获得一项针对新适应症的临床试验默示许可,拟开发治疗化疗诱导的周围神经病变(CIPN)。CIPN是癌症化疗药物的潜在神经毒性引起的严重副作用,一般会影响60%以上的癌症患者。研究表明,CIPN的发病与神经细胞线粒体功能障碍,以及相关的硝基氧化应激通路有关。根据维泰瑞隆公开资料,本次获批临床的SIR2501片是一款具有轴突保护作用机制的小分子,其具有独特的靶点抑制机制。该产品于今年2月首次在中国获批IND,针对适应症为肌萎缩侧索硬化症(ALS,“渐冻症”)。
(3)阿斯利康重磅免疫疗法度伐利尤单抗在欧盟获批新适应症,针对小细胞肺癌
3月19日,阿斯利康公司日前宣布,其重磅免疫疗法Imfinzi(durvalumab)已获得欧盟委员会批准,作为单药,用于治疗接受铂类放化疗(CRT)后病情未进展的成人局限期小细胞肺癌(LS-SCLC)患者。这一批准主要是基于发表在《新英格兰医学杂志》上的3期临床试验ADRIATIC的结果。结果显示,与安慰剂相比,Imfinzi将死亡风险降低了27%(HR=0.73;95% CI:0.57–0.93;p=0.0104)。同时,Imfinzi将疾病进展或死亡的风险降低了24%(HR=0.76;95% CI:0.61-0.95;p=0.0161),Imfinzi组的中位无进展生存期(PFS)为16.6个月,而安慰剂组为9.2个月。根据新闻稿,Imfinzi是首个获欧盟委员会批准用于治疗局限期小细胞肺癌的免疫疗法。
(4)武田创新疗法拟纳入优先审评,针对儿童和成人先天性血栓性血小板减少性紫癜
3月19日,中国国家药监局药品审评中心(CDE)官网刚刚公示,武田(Takeda)申报的注射用阿帕达酶α(Adzynma)拟纳入优先审评,适用于儿童和成人先天性血栓性血小板减少性紫癜(cTTP)患者的按需或预防酶替代治疗(ERT)。公开资料显示,这是武田研发的酶替代疗法apadamtase alfa,已经于2023年11月获美国FDA批准,为首款获FDA所批准用于治疗先天性血栓性血小板减少性紫癜(cTTP)成人和儿童患者的酶替代疗法。
(5)Travere潜在“First-in-class”疗法在美国递交监管申请,用于治疗局灶节段性肾小球硬化症
3月19日,Travere Therapeutics宣布已向美国FDA提交了Filspari(sparsentan)的补充新药申请(sNDA),用于治疗局灶节段性肾小球硬化症(FSGS)。此次申请主要基于3期DUPLEX研究和2期DUET研究的积极结果,这两项研究是在成人及儿童FSGS患者中开展的最大规模、直接对照的干预性临床试验之一。Filspari是一种具有双重机制的“first-in-class”内皮素/血管紧张素受体拮抗剂(DEARA),于2023年2月获美国FDA加速批准,用于降低有高疾病进展风险的IgA肾病患者的蛋白尿。新闻稿指出,该疗法是FDA批准治疗IgA肾病的首个非免疫抑制疗法。根据新闻稿,如果获批,Filspari将成为首个获得FDA批准用于治疗FSGS的药物。
(6)正大天晴单抗癌症新药首次在中国获批临床,靶向FGFR2Ⅲb受体
3月19日,中国国家药监局药品审评中心(CDE)官网公示,正大天晴1类新药TQB2210注射液获批临床,拟开发治疗晚期恶性肿瘤。根据正大天晴公开资料,这是一款靶向FGFR2Ⅲb受体的新型单克隆抗体药物。根据正大天晴此前新闻稿介绍,TQB2210注射液是一款靶向FGFR2Ⅲb受体的新型单克隆抗体药物,通过精准阻断肿瘤细胞生长的关键信号通路,同时激活人体免疫系统杀伤肿瘤,被视为治疗胃癌、乳腺癌、卵巢癌等FGFR2b过表达肿瘤患者的潜力药物。
(7)慕恩生物活菌1类新药获批临床,拟开发治疗超重或肥胖
3月19日,中国国家药监局药品审评中心(CDE)官网公示,慕恩生物1类新药MNO-863肠溶胶囊获批临床,拟开发治疗超重或肥胖(BMI≥24kg/㎡)的成人患者。根据慕恩生物公开资料,这是该公司研发的创新减肥活菌药物,此前已经在美国获批1期临床研究。根据慕恩生物此前新闻稿介绍,MNO-863是一款全新活菌生物药,主要成分是克里斯坦森氏菌(Christensenella sp.)的一种。MNO-863通过脑肠轴热量摄取控制、提升能量燃烧、增强糖脂代谢及调节肠道菌群与代谢物组成等多靶向创新型作用机理,能够达到持续降低患者体重的目的,而且具备高度的安全性与多药物协同性。
(8)默沙东PD-1抑制剂Keytruda胃癌或胃食管结合部腺癌适应症获得FDA完全批准
3月20日,美国FDA宣布,完全批准默沙东(MSD)公司开发的重磅PD-1抑制剂Keytruda(pembrolizumab)与曲妥珠单抗、含氟嘧啶和铂类化疗联用,一线治疗局部晚期不可切除或转移性HER2阳性胃癌或胃食管结合部腺癌成人患者。他们的肿瘤表达PD-L1(CPS≥1)。这一组合疗法的疗效在KEYNOTE-811研究中得到评估,与安慰剂联合曲妥珠单抗和化疗相比,Keytruda组合疗法组在OS和PFS方面均显示出统计学显著改善。此前,Keytruda在2021年获得FDA加速批准治疗这一适应症。
(9)恒瑞医药1类新药获批上市,针对强直性脊柱炎
3月21日,中国国家药品监督管理局(NMPA)官网公示,恒瑞医药1类新药SHR0302(硫酸艾玛昔替尼片)上市申请已获得批准,该品种适用于对一种或多种TNF抑制剂疗效不佳或不耐受的活动性强直性脊柱炎成人患者。根据恒瑞医药公开资料,这是该公司自主研发的JAK1抑制剂。艾玛昔替尼是恒瑞医药自主研发的高选择性JAK1抑制剂。它可抑制JAK1信号传导,发挥抗炎和抑制免疫的生物学效应,并减少由于JAK2抑制引起的贫血等副作用。
(10)Alnylam公司siRNA疗法Amvuttra获批新适应症,针对转甲状腺素蛋白淀粉样变心肌病
3月22日,美国FDA批准Alnylam公司的siRNA疗法Amvuttra(vutrisiran)扩展适应症,治疗ATTR-CM成人患者。Vutrisiran是一款皮下给药的siRNA疗法,基于Alnylam的增强稳定化学(ESC)-GalNAc偶联递送平台设计,增加了效力和代谢稳定性。在3期临床试验中,它将患者的全因死亡率和复发性心血管事件的风险降低了28%(HR=0.72,95% CI:0.56-0.93,P=0.01)。新闻稿指出,vutrisiran是可同时治疗ATTR淀粉样变性患者的多发性神经病(polyneuropathy)和心肌病的首款FDA批准疗法。
1.4.2本周全球TOP10积极/失败临床结果
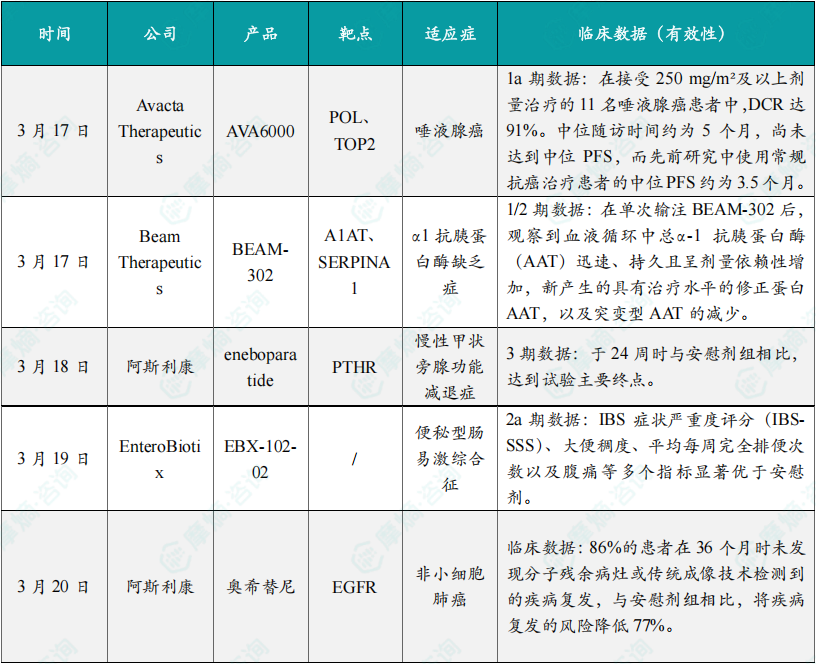
(1)Avacta公司在研多肽偶联药物1a期临床试验结果积极,针对唾液腺癌
3月17日,Avacta Therapeutics公司宣布,其在研多肽偶联药物AVA6000在治疗唾液腺癌患者的1a期临床试验中获得积极数据。AVA6000是Avacta研发管线中的首个多肽偶联药物,由阿霉素(doxorubicin)与Avacta专有的pre|CISION多肽偶联而成,该多肽可在肿瘤微环境中由成纤维细胞激活蛋白-α(FAP)特异性切割。此次公布的数据显示,与常规治疗患者相比,在接受AVA6000治疗的唾液腺癌患者中观察到令人鼓舞的PFS数据。在接受250 mg/m²及以上剂量治疗的11名唾液腺癌患者中,DCR达91%,5名患者肿瘤显著缩小,其中包括1例部分缓解(PR,肿瘤缩小超过30%)和4例轻微缓解(MR,肿瘤缩小10%-29%)。中位随访时间约为5个月,尚未达到中位PFS,而先前研究中使用常规抗癌治疗患者的中位PFS约为3.5个月。
(2)Beam公司在研单碱基编辑疗法BEAM-302 1/2期临床结果公布,用于治疗α1抗胰蛋白酶缺乏症
3月17日,Beam Therapeutics公布了在研单碱基编辑疗法BEAM-302用于治疗α1抗胰蛋白酶缺乏症(AATD)患者的1/2期临床试验结果。BEAM-302是一种针对肝脏的脂质纳米颗粒(LNP)配方,内含指导RNA(gRNA)和编码碱基编辑器的mRNA,旨在修正致病的PiZ突变。此次公布的结果显示,在单次输注BEAM-302后,观察到血液循环中总α-1抗胰蛋白酶(AAT)迅速、持久且呈剂量依赖性增加,新产生的具有治疗水平的修正蛋白AAT,以及突变型AAT的减少。在接受治疗后第7天便观察到总AAT的变化,第21天左右达到平台期,并在随访期间持续存在。中性粒细胞弹性蛋白酶抑制及结合检测均证实,增加的AAT具有功能性。
(3)阿斯利康多肽药物达3期临床主要终点,针对甲状旁腺功能减退症
3月18日,阿斯利康(AstraZeneca)公司宣布,3期临床试验CALYPSO的顶线结果显示,在研甲状旁腺激素(PTH)受体1激动剂eneboparatide(AZP-3601)在患有慢性甲状旁腺功能减退症(HypoPT)的成人中,于24周时与安慰剂组相比,达到试验主要终点。主要终点为校正白蛋白后的血清钙水平正常化以及无需依赖维生素D和口服钙治疗的复合终点。Eneboparatide是一种用于治疗慢性HypoPT的在研PTH受体1多肽激动剂,它旨在以高亲和力与PTH受体1的特定构象结合,从而恢复PTH功能以控制HypoPT症状,同时保护肾功能和骨骼健康。
(4)EnteroBiotix公司微生物组疗法临床2a期试验初步结果积极,针对便秘型肠易激综合征
3月19日,EnteroBiotix宣布,其下一代全谱微生物组疗法EBX-102-02在TrIuMPH临床2a期试验中取得了令人鼓舞的初步结果,该试验针对成人便秘型肠易激综合征(IBS-C)患者。在IBS-C队列(n=62)中,初步数据显示,接受EBX-102-02治疗的患者在多个关键疗效指标上均获得了具有临床意义的改善,包括IBS症状严重度评分(IBS-SSS)、大便稠度、平均每周完全排便次数以及腹痛。改善效果在第1周即已显现,并在随访期间持续改善。各项指标均显示EBX-102-02优于安慰剂的趋势,支持其在IBS-C治疗中的潜在益处。此外,该疗法耐受性良好,不良事件主要为轻微、自限性胃肠道反应。
(5)阿斯利康小分子组合疗法最新分析公布,近90%非小细胞肺癌患者3年持久无癌
3月20日,研究人员发表了阿斯利康重磅EGFR抑制剂奥希替尼(英文商品名Tagrisso),在3期临床试验ADAURA中,作为辅助疗法,治疗早期(IB、II和IIIA期)携带EGFR突变的非小细胞肺癌(NSCLC)患者的最新数据分析结果。数据分析显示,奥希替尼显著改善了早期肺癌患者的无病生存期。利用基于循环肿瘤DNA的灵敏检测,研究人员发现,在手术切除肿瘤后接受奥希替尼辅助治疗的患者亚群中,86%的患者在36个月时未发现分子残余病灶(molecular residual disease,MRD)或传统成像技术检测到的疾病复发。与安慰剂组相比,将疾病复发的风险降低77%(HR=0.23,95% CI:0.15-0.36)。
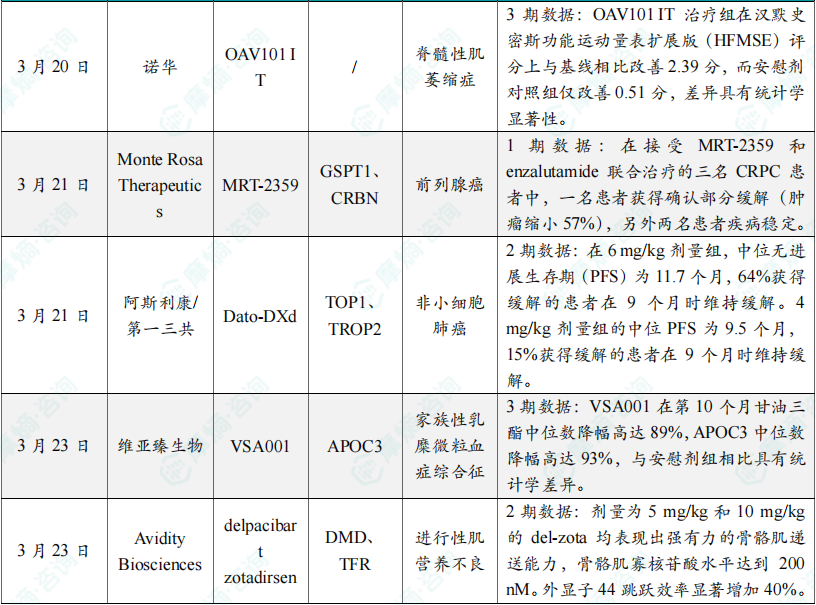
(6)诺华基因疗法OAV101 IT 3期临床结果积极,针对脊髓性肌萎缩症
3月20日,诺华公司今日宣布,在研鞘内注射基因疗法onasemnogene abeparvovec(OAV101 IT),在针对2岁至<18岁脊髓性肌萎缩症(SMA)患者群体的3期临床项目中显示出积极的安全性和疗效结果。在3期研究STEER中,OAV101 IT治疗组在汉默史密斯功能运动量表扩展版(HFMSE)评分上与基线相比改善2.39分,而安慰剂对照组仅改善0.51分,差异具有统计学显著性(P=0.0074)。在3b期研究STRENGTH中,对于已停止使用nusinersen或risdiplam治疗的患者,接受OAV101 IT治疗的患者在52周随访期间显示出运动功能的稳定。新闻稿指出,OAV101 IT是首个在儿童和青少年SMA患者中均显示临床获益且具有良好安全性的在研基因替代疗法。该公司计划在今年上半年向监管机构递交申请。
(7)Monte Rosa公司在研分子胶降解剂早期临床结果积极,用于治疗前列腺癌
3月21日,Monte Rosa Therapeutics公司今日在第四季度季报中公布了多款在研分子胶降解剂的最新临床试验结果。其中,靶向降解GSPT1的分子胶降解剂MRT-2359,在治疗对雄激素受体(AR)靶向疗法耐药的去势抵抗性前列腺癌(CRPC)患者时表现出抗癌活性。这些患者的肿瘤广泛表达c-MYC。在接受MRT-2359和enzalutamide联合治疗的三名CRPC患者中,一名患者获得确认部分缓解(肿瘤缩小57%),另外两名患者疾病稳定。所有三名患者携带的基因突变与对AR拮抗剂的耐药性相关。在两名患者中观察到前列腺特异性抗原(PSA)水平下降,其中获得确认部分缓解的患者PSA水平降低90%。
(8)阿斯利康/第一三共抗体偶联药物组合疗法最新临床结果公布,针对非小细胞肺癌
3月21日,阿斯利康公司在2025年欧洲肺癌大会的摘要中公布了该公司与第一三共联合开发的抗体偶联药物datopotamab deruxtecan(Dato-DXd),与EGFR抑制剂奥希替尼联用,2线治疗EGFR突变非小细胞肺癌患者的2期临床试验结果。数据显示,在接受奥希替尼加剂量为4 mg/kg的Dato-DXd治疗的35名患者中,客观缓解率(ORR)为43%;在接受奥希替尼加剂量为6 mg/kg的Dato-DXd治疗的34名患者中,ORR为36%。在6 mg/kg剂量组,中位无进展生存期(PFS)为11.7个月,64%获得缓解的患者在9个月时维持缓解。4 mg/kg剂量组的中位PFS为9.5个月,15%获得缓解的患者在9个月时维持缓解。
(9)维亚臻生物降脂RNAi疗法3期临床获得积极顶线数据,针对乳糜微粒血症综合征
3月23日,维亚臻生物宣布,其旗下VSA001用于治疗中国家族性乳糜微粒血症综合征患者的3期临床试验获得积极顶线数据,成功达到主要疗效终点和所有关键次要终点。VSA001(plozasiran),之前也称为ARO-APOC3,最初由Arrowhead Pharmaceuticals公司开发,是一种潜在“first-in-class”的RNAi治疗药物,旨在减少载脂蛋白C-III(APOC3)的产生。该研究的主要终点为与安慰剂组相比,第10个月的空腹血清甘油三酯水平相较于基线的中位变化百分比。VSA001在第10个月甘油三酯中位数降幅高达89%,APOC3中位数降幅高达93%,与安慰剂组相比具有统计学差异。除了成功达到研究主要终点外,VSA001还达到所有关键次要研究终点,包括第10个月和第12个月血清空腹甘油三酯相较于基线变化百分比,以及第10个月和第12个月APOC3水平相较于基线变化百分比。
(10)Avidity Biosciences公司在研罕见病疗法1/2期临床结果公布
3月23日,Avidity Biosciences公司用于治疗DMD的在研疗法delpacibart zotadirsen(del-zota)在1/2期EXPLORE44临床试验中展现出“史无前例”的抗肌萎缩蛋白表达能力。研究显示,剂量为5 mg/kg和10 mg/kg的del-zota均表现出强有力的骨骼肌递送能力,骨骼肌寡核苷酸水平达到200 nM。外显子44跳跃效率显著增加40%。抗肌萎缩蛋白生成显著增加,平均增加至正常水平的25%,最高达到正常水平的58%。肌酸激酶水平下降至接近正常水平,相比基线减少了超过80%。基于这些积极数据,Avidity决定在未来的临床研究中采用5 mg/kg(每6周一次给药)的剂量方案,并以此支持生物制品许可申请(BLA)的递交。公司计划最迟于2025年年底前向FDA提交BLA申请。
同期事件:
1. 2025年第12周03.17-03.23国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第12周03.17-03.23国内仿制药/生物类似物申报/审批数据分析
3. 2025年第12周03.17-03.23国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.17-2025.03.23)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论