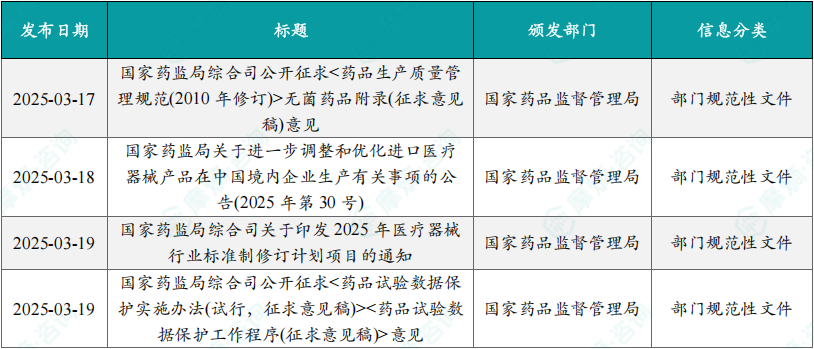
1.3.1本周国内医药大健康行业政策法规速览
1.3.2本周重点行业政策详细说明
(1)《国家药监局综合司关于印发2025年医疗器械行业标准制修订计划项目的通知》
3月19日,国家药监局综合司制定并发布了2025年医疗器械行业标准制修订计划项目,旨在全面深化药品医疗器械监管改革,促进医药产业高质量发展。此次制修订计划项目包括麻醉和呼吸设备人工复苏器、热传导式理疗设备通用技术要求等6个强制性行业标准制修订计划项目,以及重组胶原蛋白降解试验方法通则、中枢神经系统感染病原体宏基因组测序技术要求等79个推荐性行业标准制修订计划项目。
2025年医疗器械行业标准制修订计划项目的发布和实施,标志着我国医疗器械监管改革的进一步深化。通过不断完善标准体系,将为医疗器械行业的高质量发展奠定坚实基础,推动我国医疗器械产业迈向新的台阶。
(2)《药品试验数据保护实施办法(试行,征求意见稿)》
3月19日,国家药监局起草并发布了《药品试验数据保护实施办法(试行,征求意见稿)》和《药品试验数据保护工作程序(征求意见稿)》,旨在促进药品创新和仿制药发展,完善药品试验数据保护制度。根据《实施办法》,含有新型化学成份的药品以及符合条件的其他药品获批上市时,国家药监局对申请人提交的自行取得且未披露的试验数据和其他数据实施保护,给予最长不超过6年的数据保护期。在数据保护期内,其他申请人未经药品上市许可持有人同意,依赖前款数据申请药品上市许可或者补充申请的,国家药监局不予许可,其他申请人自行取得数据的除外。
此次征求意见稿里对首次在境内上市的创新药、改良药,境外已上市境内申请上市的药品等都明确了数据保护期。保护期限方面,自创新药首次境内上市许可之日起,给予6年数据保护期(创新药相关数据保护);自改良型新药首次境内上市许可之日起,给予3年数据保护期(改良型新药相关数据保护);对首家获得批准的境外已上市境内未上市原研药品的仿制药(含境外生产药品)和生物制品给予3年数据保护期(仿制药品相关数据保护)。
同期事件:
1. 2025年第12周03.17-03.23国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第12周03.17-03.23国内仿制药/生物类似物申报/审批数据分析
3. 2025年第12周03.17-03.23全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.17-2025.03.23)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论