1.1.1总体概况
根据摩熵数据统计,2024.12.23-2024.12.29期间共有124个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号103个,进口药品受理号21个。
本周共计30款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药13款,生物药15款,中药2款。其中值得注意的有:
(1)JSKN-033注射液
12月24日,CDE官网公示:康宁杰瑞制药的JSKN-033注射液获得临床试验默示许可,适用于治疗晚期恶性肿瘤,包括但不限于宫颈癌、子宫内膜癌、卵巢癌、胃/胃食管结合部腺癌、结直肠癌、非小细胞肺癌、尿路上皮癌等。公开资料显示,JSKN-033注射液是一种HER2双特异性抗体偶联药物与PD-(L)1免疫检查点抑制剂的高浓度皮下注射复方制剂,由JSKN033由JSKN003和恩沃利单抗(KN035)组成,是全球首个皮下注射PD-(L)1抑制剂。
(2)PD-DP-008凝胶
12月24日,CDE官网公示:佩德生物的PD-DP-008凝胶获得临床试验默示许可,适用于治疗寻常痤疮。公开资料显示,PD-DP-008凝胶活性成分来源于青蛙的皮肤分泌物中的天然多肽,研发团队精心设计与改良后,通过特有的作用机制与致病菌的细胞膜发生作用,导致细菌破裂死亡从而达到杀菌的目的。
(3)TBA片
12月24日,CDE官网公示:博济医药和固麦迪健康联合研发的TBA片获得临床试验默示许可,用于治疗耐药肺结核。公开资料显示,TBA片作用于结核分枝杆菌电子传递链中的QcrB,抑制其呼吸作用。
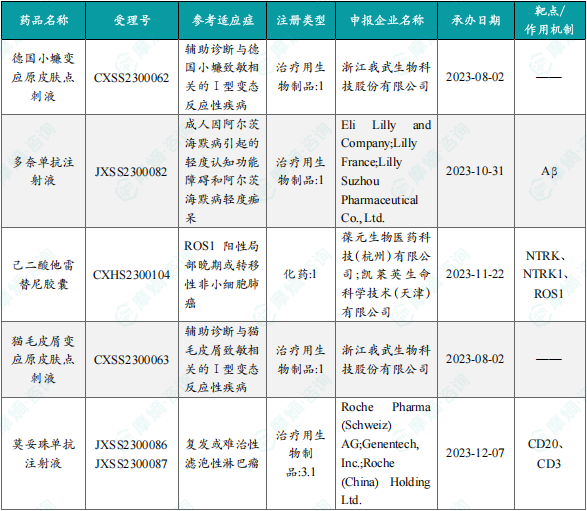
本周共6款新药获批上市,即德国小蠊变应原皮肤点刺液、多奈单抗注射液、己二酸他雷替尼胶囊、猫毛皮屑变应原皮肤点刺液、莫妥珠单抗注射液和悬铃木花粉点刺液。
· 12月23日,国家药监局发布药品批准证明文件送达信息:罗氏的莫妥珠单抗注射液获批上市,用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。公开资料显示,注射用莫妥珠单抗注射液是一款靶向B细胞表面的CD20抗原和T细胞表面的CD3受体的T细胞衔接双特异性抗体。
· 12月23日,国家药监局发布药品批准证明文件送达信息:礼来的多奈单抗注射液获批上市,用于治疗成人因阿尔茨海默病引起的轻度认知功能障碍和阿尔茨海默病轻度痴呆。公开资料显示,多奈单抗注射液是一款特异性靶向N3pG(修饰化β淀粉样蛋白斑块)的单克隆抗体药物,能够识别并结合到大脑中沉积的β淀粉样蛋白(Aβ)斑块上的N-末端焦谷氨酸修饰表位。
· 12月23日,国家药监局发布药品批准证明文件送达信息:葆元生物的己二酸他雷替尼胶囊获批上市,适用于经ROS1-TKI治疗后进展的ROS1阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,为患者提供新的治疗选择。公开资料显示,己二酸他雷替尼胶囊是一款全新一代ROS1/NTRK抑制剂。
· 12月23日,国家药监局发布药品批准证明文件送达信息:我武生物的3种变应原皮肤点刺液获批上市,分别为德国小蠊变应原皮肤点刺液、猫毛皮屑变应原皮肤点刺液、悬铃木花粉变应原皮肤点刺液。以上品种用于皮肤点刺试验,分别辅助诊断与德国小蠊、猫毛皮屑、悬铃木花粉致敏相关的Ⅰ型变态反应性疾病。
1.1.2本周获批临床创新药/改良型新药信息速览(不含补充申请)
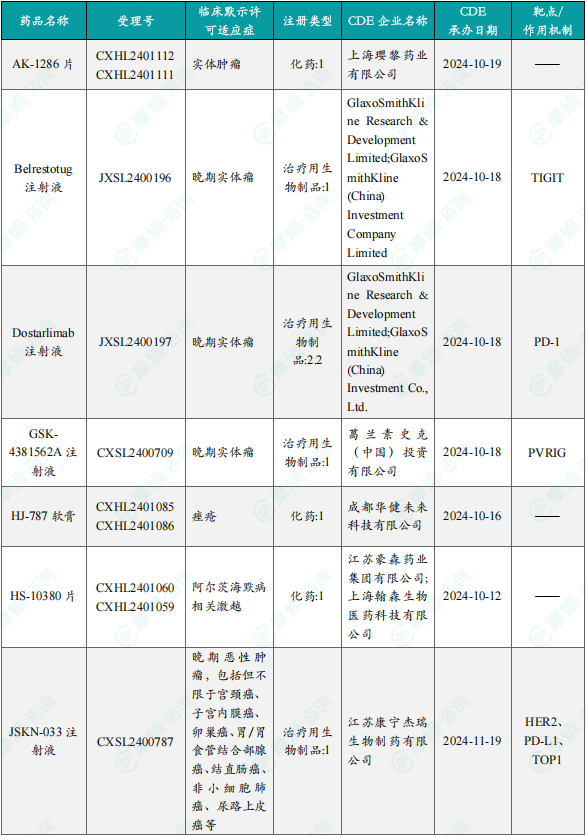
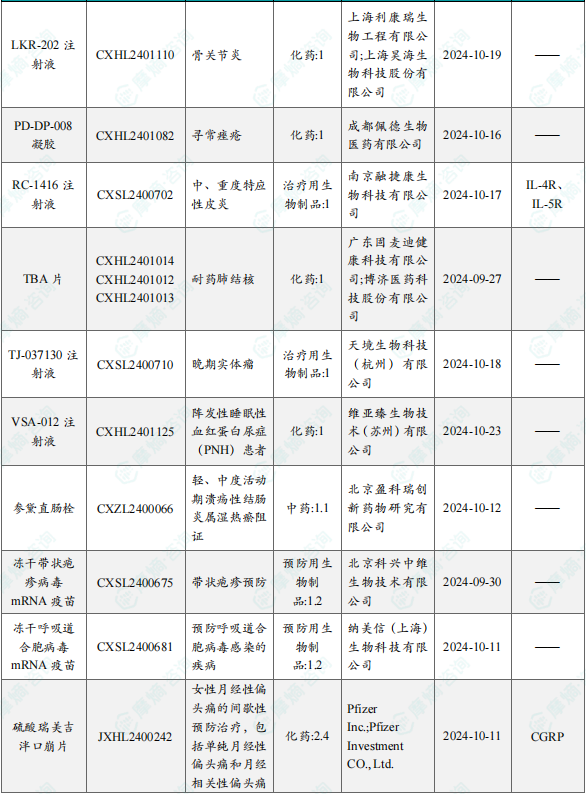
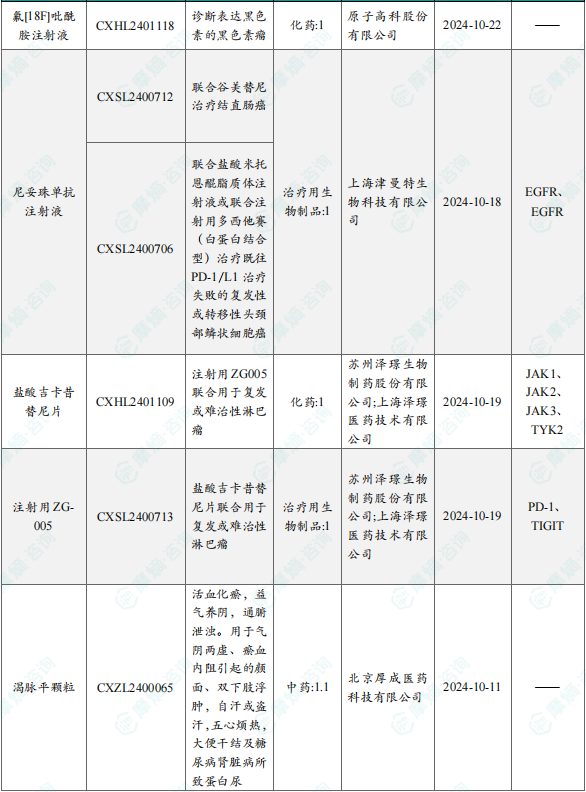
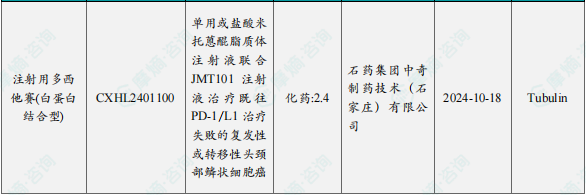
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3本周获批上市创新药信息速览

备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵数据库获取并下载EXCEL表格。
同期事件:
1. 2024年第52周12.23-12.29国内仿制药/生物类似物申报/审批数据分析
2. 2024年第52周12.23-12.29国内医药大健康行业政策法规汇总
3. 2024年第52周12.23-12.29全球医药大健康行业投融资数据
4. 2024年第52周12.23-12.29全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2024.12.23-2024.12.29)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论