多囊卵巢综合征
PCOS是育龄妇女中一种常见的生殖疾病,以雄激素过多、排卵功能障碍和多囊卵巢为特征,是影响育龄妇女最常见的内分泌疾病之一,患病率为10 - 13%。目前治疗多囊卵巢综合征的方法非常有限,主要针对特定症状进行相应治疗,因此开发创新且全面的治疗策略迫在眉睫。
文献信息
2024年6月,复旦大学汤其群教授带领的研究团队在《Science》上发表了题为“Artemisinins ameliorate polycystic ovarian syndrome by mediating LONP1-CYP11A1 interaction(青蒿素通过介导LONP1-CYP11A1相互作用改善多囊卵巢综合征)”的研究论文。
雄激素过量是PCOS众多表型的主要驱动因素,因此控制雄激素的量至关重要。青蒿素是一种从青蒿属植物中分离出来的分子,在本次研究中,作者发现青蒿素及其衍生物,包括蒿甲醚(ATM)、青蒿琥酯(ATS)和SM934,可通过抑制卵巢中雄激素的合成来阻止雄激素过量产生。小鼠模型和人类临床试验结果表明青蒿素可通过调节LONP1-CYP11A1相互作用显著改善PCOS表型,这一研究结果为PCOS的综合治疗提供了新的方案。
汉恒生物提供的CYP11A1过表达HEK293T稳转株和LONP1敲除的HEK293T细胞株助力了该研究。
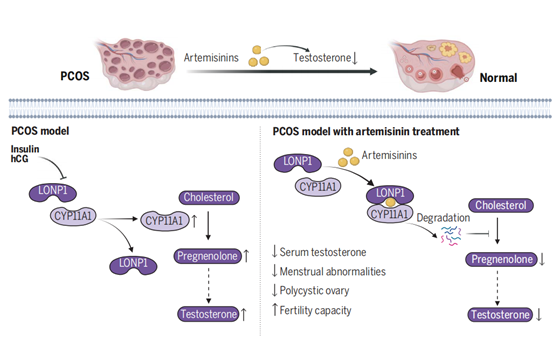
图1. 青蒿素抑制卵巢雄激素合成,缓解多囊卵巢综合征

研究成果
1.在啮齿类动物模型中,ATM对PCOS样表型有抑制作用
为了评估青蒿素在PCOS中的作用,作者使用脱氢表雄酮(DHEA)建立了PCOS样小鼠模型,并同时给药ATM(图2A-B),发现ATM可抑制睾酮升高,防止PCOS样特征(图2C),改善由DHEA引发的发情周期中断(图2D),恢复卵巢卵泡正常形态(图2E)。并且给药ATM后,小鼠各项代谢指标(体重、脂肪质量、葡萄糖耐量等)均显示正常,没有出现肝毒性症状,说明ATM是安全的。
接着,作者通过腹腔注射不同剂量的ATM处理PCOS样小鼠以进一步评估ATM的治疗效果(图2F),结果显示ATM以剂量依赖的方式降低血清睾酮(图2G),恢复正常的发情周期(图2H),抑制子宫水肿(图2I),并显著减少卵巢囊泡(图2J),口服ATM效果相似(图2K-O)。另外,作者构建了PCOS样大鼠模型,腹腔注射ATM后,其PCOS特征得到显著改善(图3),与PCOS样小鼠模型结果相似。综上,在啮齿类动物模型中,ATM能够改善PCOS表型特征,包括血清睾酮水平升高、发情周期不规则、多囊卵巢形态和低生育能力。
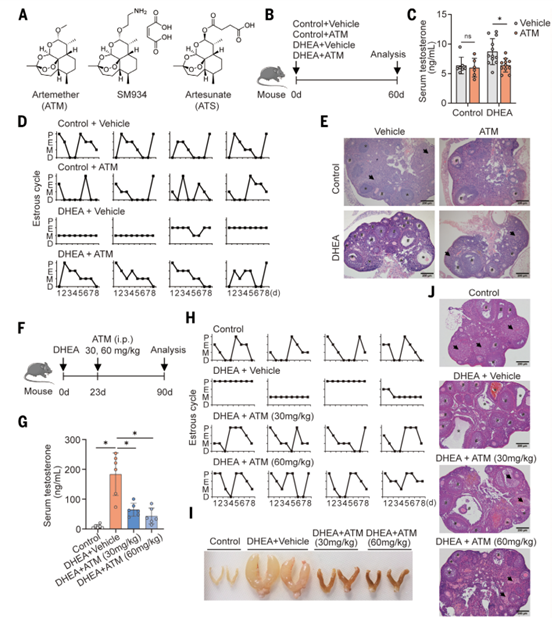
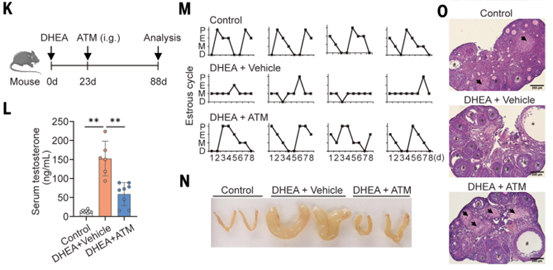
图2. PCOS样小鼠模型ATM给药实验结果
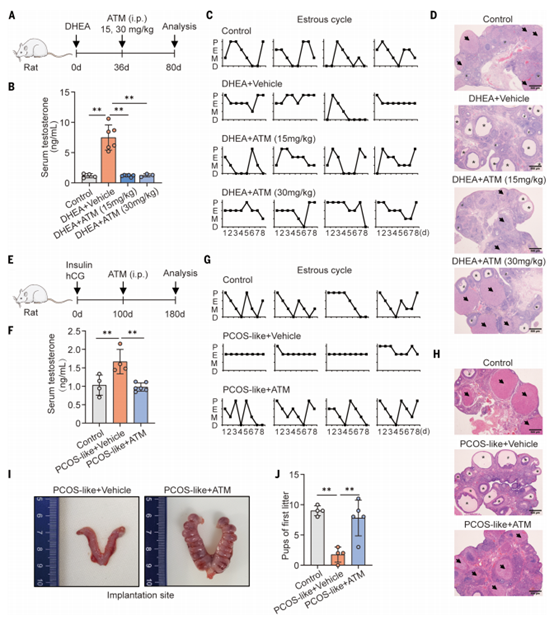
图3. PCOS样大鼠模型ATM给药实验结果
2.青蒿素抑制卵巢中的甾体激素生成和睾酮产生
雄激素过量是PCOS众多表型的主要驱动因素,因此作者开始探究青蒿素在调节雄激素合成中的作用。下丘脑-垂体-卵巢轴是雄激素生成的途径,在PCOS样啮齿类动物模型中给药ATM,控制类固醇激素(包括黄体酮、雄激素和雌激素)合成的促卵泡激素(FSH)和黄体生成素(LH)均未发生变化,由此作者推测ATM可能不会改变促性腺激素的产生,进而假设青蒿素通过靶向卵巢调节睾酮水平。作者测量了卵巢间质细胞上清液中的类固醇激素,发现ATM和SM934 以剂量依赖的方式抑制肠间质细胞中睾酮的产生(图4B-C)。除此之外,ATM和SM934还明显降低孕烯醇酮、孕酮和17a-OHP,这些都是甾体激素的中间体和睾酮的前体(图4D至I)。这些数据表明,青蒿素抑制卵巢膜间质细胞的类固醇生成过程和随后的雄激素合成。
作者对分离的膜间质细胞进行了质谱相对定量蛋白质组学分析以揭示青蒿素诱导雄激素合成减少的机制,发现CYP11A1是ATM诱导之后下调最显著的蛋白(图4J)。CYP11A1催化胆固醇向孕烯醇酮的转化,这是类固醇激素生物合成的第一步。ATM导致CYP11A1下调,孕烯醇酮降低,与先前观察到的青蒿素抑制雄激素合成相符(图4D和G)。接着作者检测了小鼠和大鼠间质细胞中类固醇生成酶的表达,结果显示青蒿素剂量依赖性地下调CYP11A1蛋白(图4K)。另外,ATM可显著下调PCOS样小鼠卵巢中的CYP11A1蛋白(图4L)。
为了进一步阐明CYP11A1的降低是否介导了青蒿素对睾酮合成的抑制作用,作者向经青蒿素处理的细胞膜间质细胞补充孕烯醇酮,这是CYP11A1催化反应的产物,会被青蒿素还原(图4A),结果孕烯醇酮的补充显著逆转了青蒿素诱导的孕酮、17a-OHP和睾酮的下降(图4M)。过表达CYP11A1能够恢复青蒿素处理细胞中下降的睾酮(图4N)。敲低CYP11A1后,青蒿素无法进一步降低孕酮、17a-OHP和睾酮的产生(图4O)。这些结果共同表明,上调和下调CYP11A1决定了睾酮的产生,青蒿素通过CYP11A1影响睾酮的产生。
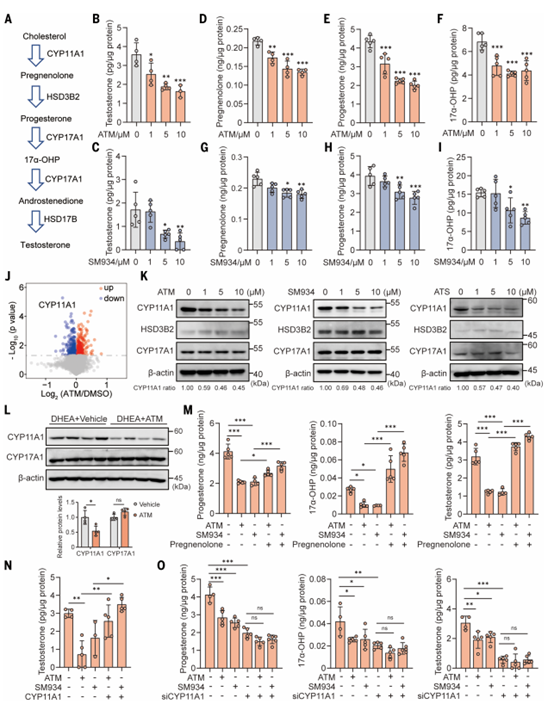
图4.青蒿素通过下调CYP11A1抑制卵巢甾体生成和睾酮产生
3.青蒿素介导LONP1和CYP11A1之间的相互作用
那么,青蒿素是如何调节CYP11A1的呢?为阐明青蒿素的作用机制,作者显示检测了CYP11A1的稳定性,发现ATM和SM934明显缩短了CYP11A1蛋白的半衰期(图5A),蛋白酶抑制剂MG132可恢复CYP11A1的蛋白水平(图5B),表明青蒿素通过抑制其蛋白稳定性来降低CYP11A1水平。为了确定导致青蒿素诱导的CYP11A1不稳定的介质,作者应用免疫沉淀联用质谱(IP-MS)来鉴定ATM或SM934处理后与CYP11A1相互作用的物质(图5C)。在IP-MS数据的基础上,作者确定了2个特异性地与CYP11A1相互作用的蛋白,长肽酶1(LONP1)和从内质网转运到高尔基调节蛋白(TFG)(图5C)。
LONP1是利用ATP水解降解错误折叠或氧化的蛋白质,在线粒体蛋白质质量控制中至关重要。TFG是一种COPII囊泡相关蛋白,可调节内质网到高尔基体的转运。作者通过CYP11A1- flag共免疫沉淀(co-IP)和LONP1过表达实验发现,ATM和SM934可显著增强LONP1和CYP11A1之间的相互作用(图5D)。相比之下,ATM可以略微增强TFG-CYP11A1的相互作用,而SM934则不能。LONP1过表达显著下调CYP11A1,而TFG对其没有影响。内源性co-IP进一步证实,ATM和SM934增强了LONP1和CYP11A1之间的结合亲和力(图5E)。以上实验结果表明青蒿素增强了CYP11A1-LONP1的相互作用。
接着,作者使用蛋白分子对接工具预测了CYP11A1-LONP1的结合位点,结果显示CYP11A1中W56 ~ S66或F252 ~ T259残基可能是两者的结合位点。于是,作者制备了删除W56-S66(△W56-S66)或F252-T259(△F252-T259)残基的CYP11A1的突变体通过co-IP 实验发现△W56-S66保留了与LONP1相互作用的能力,△F252-T259则失去了与LONP1结合的能力(图5F),这表明CYP11A1中F252-T259区域对于CYP11A1-LONP1相互作用至关重要。而LONP1的所有结构域都表现出与CYP11A1的强相互作用,没有结构域选择性(图5H)。

图5. 青蒿素增强LONP1和CYP11A1之间的相互作用
4.LONP1促进CYP11A1降解,抑制睾酮合成
确认青蒿素可增强CYP11A1-LONP1的相互作用后,作者试图揭示LONP1在青蒿素诱导的CYP11A1降解中的作用。LONP1过表达降低了CYP11A1水平,蛋白酶抑制剂MG132则可以恢复CYP11A1水平(图6A),使用LONP1抑制剂或siRNA敲低LONP1均可逆转ATM引起的CYP11A1表达的降低(图6B-C)。LONP1的844位氨基酸是负责蛋白质降解的催化二元体,作者制备了LONP1S844A突变体,发现突变体无法像WT LONP1降低CYP11A1的表达(图6D)或缩短CYP11A1蛋白的半衰期(图6E),表明LONP1通过蛋白酶活性下调CYP11A1。
为了证实LONP1是否直接介导了CYP11A1的下调,作者使用纯化的CYP11A1和LONP1蛋白进行了体外蛋白酶测定。研究结果表明,ATM促进LONP1降解CYP11A1,而在缺乏LONP1的情况下,ATM对CYP11A1没有影响(图6F)。随后,作者评估了LONP1对卵巢雄激素合成的影响。腺病毒介导的间质细胞或BeWo细胞中LONP1的过表达下调了CYP11A1蛋白(图6H)。由于CYP11A1的降低,细胞间质细胞的孕烯醇酮、孕酮、17a-OHP和睾酮含量显著降低(图6I-L)。小鼠卵巢中过表达LONP1后,CYP11A1表达量和血清睾酮含量均下降(图6M-N)。这些数据表明,LONP1的过表达可促进CYP11A1降解,抑制睾酮合成。
基因表达综合数据库(GEO)的公开数据GSE1615表明,PCOS患者的卵泡膜细胞中LONP1的表达水平显著(P = 0.0104)低于正常卵泡膜细胞(图6O),与上述LONP1抑制CYP11A1和雄激素合成的实验结果相符。
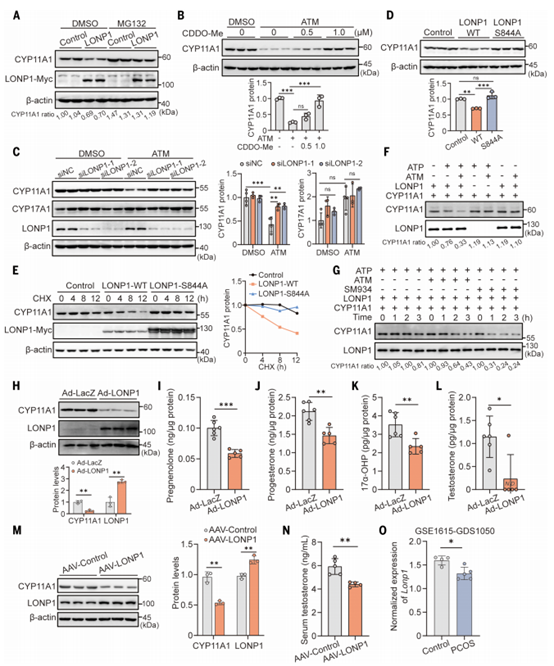
图6. LONP1促进CYP11A1的降解
5.LONP1是青蒿素的直接靶点
青蒿素是否直接靶向LONP1或CYP11A1,为证实这一猜想,作者使用生物素与青蒿素偶联(bio-ATS)进行下拉实验(图7A),发现bio-ATS对LONP1蛋白而不是CYP11A1具有结合亲和力(图7B)。同时热稳定性实验为青蒿素和LONP1之间的相互作用提供了额外的证据,ATM对LONP1的热稳定性有影响,而对CYP11A1没有影响(图7C)。这些数据表明LONP1是青蒿素的直接靶点。
为了进一步研究青蒿素与LONP1的结合模式,作者分析了LONP1的蛋白质结构,发现青蒿素衍生物会对接到LONP1蛋白水解区域内已知的硼替佐米结合口袋(图7D)。基于该预测结果,作者制作并纯化了该结构域,并测定了青蒿素与该结构域的结合亲和力(图7E-G)。为了再次验证这一结论,作者制备了一个缺失G847到D852残基的LONP1突变体(△GATPKD)和LONP1敲除细胞。LONP1敲除细胞中CYP11A1表达上升,在细胞中过表达 WT-LONP1和△GATPKD可下调CYP11A1表达,表明△GATPKD仍然保留了降解CYP11A1的蛋白酶活性(图7J)。当用青蒿素处理这些细胞时,对照细胞中的CYP11A1下调,但LONP1敲除细胞中CYP11A1水平保持不变。重新引入WT-LONP1可恢复青蒿素对CYP11A1的抑制作用,而重新引入突变体LONP1未能逆转青蒿素诱导的CYP11A1下调(图7J),这可能是因为突变体LONP1无法与青蒿素结合。以上实验结果表明青蒿素对CYP11A1水平的抑制作用很大程度上依赖于其与LONP1蛋白水解结构域的结合。
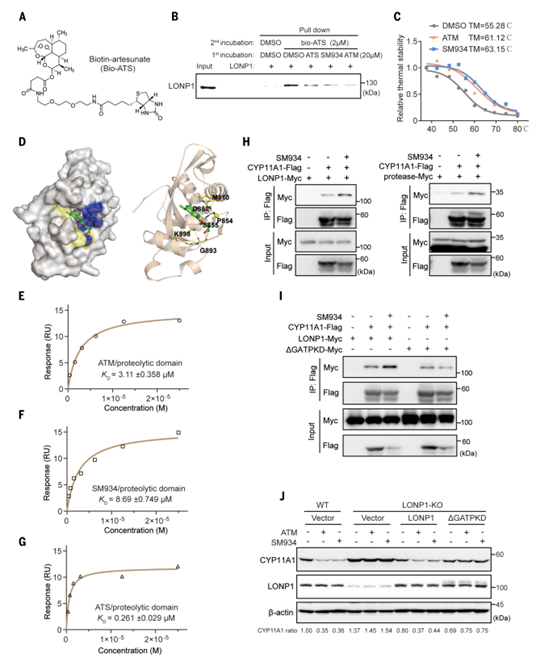
图7. LONP1是青蒿素的直接靶点
6.双氢青蒿素治疗多囊卵巢综合征的疗效观察
最后,作者进行了一项试点临床研究,以验证青蒿素治疗多囊卵巢综合征患者的疗效。19名PCOS患者[女性,年龄27.79±3.74岁;重量:62.1±8.9 kg;体重指数(BMI: 23.23±2.30 kg/m2)在治疗前都表现出高雄激素血症、少月经、闭经和多囊卵巢的症状,口服双氢青蒿素(40 mg,每日3次)治疗12周,治疗期间没有观察到任何副作用。双氢青蒿素治疗显著降低了PCOS患者的血清睾酮(图8A)。抗勒氏激素(AMH)主要由卵巢腔前卵泡和小腔卵泡的颗粒细胞产生,其水平与生长卵泡的数量密切相关,在PCOS患者中通常升高。结果显示双氢青蒿素治疗显著降低了血清AMH(图8B),与之一致的是,超声检查发现,双氢青蒿素治疗后窦腔卵泡计数明显减少(图8C)。此外,63.16%(12/19)的PCOS患者恢复了正常的月经周期(图8D)。以上数据表明双氢青蒿素可有效改善PCOS患者高雄激素血症,改善多囊卵巢形态,恢复正常月经周期。
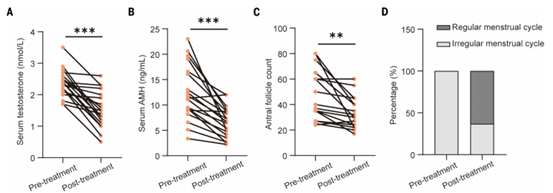
图8. 双氢青蒿素治疗多囊卵巢综合征的疗效观察
总结
这项研究表明,青蒿素通过直接与LONP1结合,启动LONP1与CYP11A1之间的相互作用,促进CYP11A1的降解,进而抑制卵巢中雄激素的合成,在小鼠模型和人类患者中都能有效缓解PCOS相关症状,说明青蒿素及其衍生物可作为有效治疗PCOS的潜在药物,该研究为治疗PCOS提供了新的策略。
往期精选





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论