
在上一篇文章(从AI包揽诺奖到行业风口,剂泰医药的思考与前瞻),剂泰医药的科学家详细谈了AI在生物科学领域的应用与思考。这一篇文章,我们邀请到了剂泰医药RNA方面的科学家来聊聊今年诺贝尔生理学或医学奖颁给的microRNA,以及近年来备受关注的RNAi、siRNA、mRNA之间的区别和实际应用。

2024年诺贝尔生理学或医学奖授予了维克托·安布罗斯(Victor Ambros)和加里·鲁夫昆(Gary Ruvkun),以表彰他们在microRNA(miRNA,即微小RNA)方面的开创性研究,这种小型RNA分子在基因表达的调控中发挥了至关重要的作用。这是继2023年mRNA核苷酸修饰相关的研究获得诺奖之后,RNA技术再次引发全球瞩目。RNA作为一种重要的生物分子,正在不断地革新我们对基因调控、细胞功能以及疾病治疗的理解。因此,了解RNA的基础以及RNA技术的应用变得尤为关键。


RNA,全称为核糖核酸(Ribonucleic Acid),是生物体内重要的遗传信息载体,与DNA一起构成了生命的遗传蓝图。核酸(DNA或RNA)依赖其包含的碱基互补配对相互作用,这种相互作用就核酸执行其许多生物功能的关键分子基础之一。与DNA不同,RNA保留了核糖2’-O基团,RNA的单链结构更为灵活,具备多种功能,可以作为基因表达的信息传递者、催化化学反应的酶、以及调控基因表达的分子。

在讨论miRNA之前,我们必须提到荣获2006年诺贝尔生理学或医学奖的RNA干扰(RNAi)技术。RNAi于1998年由安德鲁·费尔(Andrew Fire)和克雷格·梅洛(Craig Mello)发现,是一种通过siRNA(小干扰RNA)沉默特定基因表达的机制。这一发现彻底改变了科学界对基因表达调控的认知。

图1,中心法则,图片来源:NIH官网,参考资料[1]
miRNA是一类普遍存在于真核生物中的小型RNA分子,长度大约为21~23个核苷酸。miRNA的生物合成始于细胞核内,由RNA聚合酶II或III转录产生较长的初级转录本(pri-miRNA)。在Drosha和DGCR8蛋白的作用下,pri-miRNA被加工成具有茎环结构的前体miRNA(pre-miRNA)。通过Exportin-5,pre-miRNA被转运至细胞质,并在Dicer蛋白的剪切下成为成熟的miRNA。
成熟的miRNA通过与RNA诱导沉默复合体(RISC)结合,与目标mRNA的3’非翻译区(3’UTR)部分互补配对,从而调控基因表达。miRNA和mRNA的结合有两种形式:完全配对和不完全配对。完全配对会触发对mRNA的酶切降解,而不完全配对则通过空间位阻影响mRNA的翻译,最终可能导致mRNA的降解甚至酶切(图2)。

miRNA在不同组织和细胞中的分布丰度有所不同,这种差异使细胞实现特异性的基因调控。这种调控机制为mRNA疗法提供了新的途径,通过mRNA序列本身实现组织特异性表达,为实现更精准的治疗效果提供了可能。

现在我们回顾2006年诺贝尔奖的RNAi技术,其核心即是反式RNA互作介导的基因沉默机制,即通过siRNA(小干扰RNA)或miRNA(微小RNA)来抑制特定基因mRNA的表达。
与细胞自身产生miRNA来调控基因不同在于,RNAi技术使用中,外源的siRNA被引入细胞后加载到RNA诱导沉默复合体(RISC)上,与靶标mRNA做到完全匹配,进而导致靶标mRNA降解,最终降低目的蛋白的表达(图2)。
换句话说,外源性的siRNA与能完全匹配靶标mRNA的内源性miRNA在抑制mRNA表达的机制是一样的。
因此,早在2006年梅洛在RNAi获得诺贝尔奖后接受记者采访时候就曾说过,” …我认为诺贝尔委员会未来应该考虑表彰小RNA的发现,这会是一个不同的故事。小RNA,尤其是microRNA(我相信你应该听说过那些在发育过程中调控基因表达的小RNA),是我们发现之后不久取得的重大发现之一,这确实非常令人兴奋。”
所以RNAi的技术更像是切入细胞内miRNA调控基因过程的一种黑客技术——生物体内的一个调控网络的接口(siRNA或miRNA配对调控)被掌控,进而通过外源合成的siRNA截获对生物体基因进行沉默的控制权。这个操作又像极了另一个RNA技术—mRNA治疗,与RNAi相反,在这个截获的调控网络控制里,mRNA治疗针对某个目的基因进行正调控,弥补或提高其表达水平进而来达到治疗的目的(图3)。

RNAi技术在RNA治疗领域的应用催生了Alnylam,Arrowhead,和Dicerna等领先的siRNA药物公司。自2006年RNAi技术获得诺贝尔奖之后的十年内几经起落的Alnylam凭借深厚的技术积累和不断创新,在经历多次市场挑战和技术迭代后,逐渐成长为RNA治疗赛道的领跑者。如今随着miRNA与RNA沉默调控机制再次获得诺贝尔奖的认可,这一领域的RNA技术也必将得到更多的关注和发展。
对于决心深耕RNA治疗,专注于mRNA治疗的剂泰医药而言,miRNA和RNAi技术的发展历程不仅彰显了RNA治疗的巨大潜力,同时也为我们在mRNA技术面临的多重挑战中带来了新的启示。这些前沿思路为我们进一步探索mRNA治疗的应用路径、克服技术瓶颈提供了重要借鉴。

mRNA治疗作为一种新兴的生物技术,因其独特的优势获得了全球瞩目。mRNA的技术潜力在新冠疫苗的成功中得到了前所未有的验证,展现了其快速制备、较低成本及高安全性的特点。然而,除了疫情紧急状态的推动之外,mRNA成药仍面临多重技术挑战,这使得其走向更广泛的治疗应用变得复杂。特别是,要想超越传染病疫苗的局限性,开发出治疗其他疾病的mRNA药物,我们需要解决以下三个关键技术屏障:
1. 稳定且高效的蛋白质表达
有效的mRNA药物必须能够在细胞内稳定地持续表达目标蛋白,而不仅仅是短时间的表达。要实现这一目标,RNA的设计必须从mRNA的序列稳定性和翻译效率入手,以确保在细胞中长期有效且持续地发挥作用。
2. 高效的组织特异性递送
将mRNA药物精确递送到特定的组织和细胞中,是实现治疗效果的关键之一。目前,许多mRNA治疗公司在探索如何开发安全有效的递送系统,使mRNA能准确进入靶向组织。实现这种高度特异性递送的挑战,依赖于递送载体和RNA序列设计的双向改进。
3. 免疫原性控制
mRNA的免疫原性,即其在体内引发免疫反应的能力,是mRNA成药的另一大难题。尽管免疫系统的激活对疫苗而言是必须的,但在治疗性mRNA药物中,免疫反应的诱发应当被严格控制,以避免不必要的免疫反应。因此,我们需要进一步优化mRNA的序列和修饰技术,使其能够在发挥作用的同时避免触发过度的免疫反应。
面对这些挑战,许多mRNA治疗会选择先从疫苗研发入手,以绕开上述的技术瓶颈。而在剂泰医药,我们选择全方位穿透这些屏障,从而拓宽mRNA在更广泛治疗领域的应用潜力。我们的AiRNA平台(AI驱动mRNA设计与高通量合成平台)通过整合RNA生物元件设计、AI算法开发及高通量实验筛选,构建了一套创新的技术解决方案,致力于推动mRNA药物开发的未来。
剂泰医药的AiRNA平台融合了多个学科的创新理念,成为mRNA治疗技术领域的重要工具。我们通过De Novo设计RNA生物元件,包括miRNA调控元件,开发了先进的AI算法,进一步通过内部搭建的高通量实验筛选平台,以系统性地解决mRNA治疗的关键问题。
尤其令人振奋的是,2024年诺贝尔奖对miRNA和深度学习AI的关注进一步肯定了我们所选技术路线的正确性。在具体的技术应用中,我们利用生成模型对海量的UTR序列数据集进行深度学习训练。通过分析数百万序列级别的转录组和核糖体图谱数据我们建立了5’和3’UTR生成模型,构建了500多个报告基因UTR文库。这一文库经过高通量多细胞系表征筛选,可提供具有普遍性和细胞特异性的UTR组合,进一步优化了mRNA的表达性能(图4)。
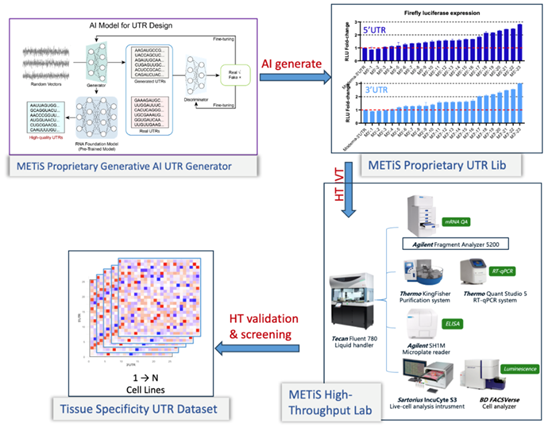
图4,剂泰医药AiRNA平台,图片来源:剂泰医药
与此同时,我们基于mRNA全长序列开发的密码子优化算法,能够在保证稳定性的同时,平衡翻译效率,并实现特定区间的保守性设置的同时实现全局最优设计。

mRNA技术的未来充满希望,但要将这种希望转化为现实,需要不断地技术创新和优化。剂泰医药致力于成为这一领域的领导者,为全球患者提供更高效、更精准的RNA治疗解决方案。
1. https://www.genome.gov/genetics-glossary/Central-Dogma
2. Lam, J. K. W., Chow, M. Y. T., Zhang, Y. & Leung, S. W. S. siRNA Versus miRNA as Therapeutics for Gene Silencing. Molecular Therapy - Nucleic Acids 4, e252 (2015).
3. Dong, Y. & Anderson, D. G. Opportunities and Challenges in mRNA Therapeutics. Acc. Chem. Res. 55, 1–1 (2022).
4. Bhat, B., Karve, S. & Anderson, D. G. mRNA therapeutics: beyond vaccine applications. Trends in Molecular Medicine 27, 923–924 (2021).
5. Bajan, S. & Hutvagner, G. RNA-Based Therapeutics: From Antisense Oligonucleotides to miRNAs. Cells 9, 137 (2020).
6. 诺贝尔奖官方网站https://www.nobelprize.org/
7. 剂泰医药官方网站https://www.metispharma.com/
进一步了解剂泰医药
相关阅读:





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论