
2月22日,据CDE官网显示,齐鲁制药(海南)提交的4类仿制药马立巴韦片上市申请获受理。马立巴韦片为抗病毒制剂,据摩熵医药数据库(跨国药企销售数据)显示,在2023年武田制药的马立巴韦片的全球销售额达191亿日元,折合人民币约为9.62亿元。
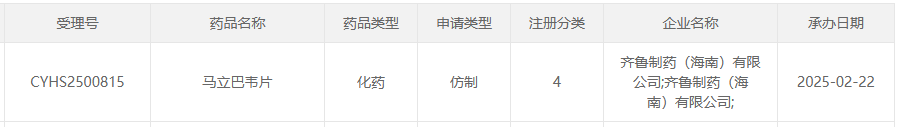
截图来源:CDE
马立巴韦片原药药企为武田制药,最早于2021年11月获FDA批准上市,属于苯并咪唑核苷类药物,是全球首个且目前唯一一个靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制剂。可通过抑制CMV病毒的pUL97蛋白激酶,阻断病毒的复制。它具有抑制CMV病毒复制的创新机制,具有更高的安全性。2023年12月19日在中国获批上市,2024年11月进入国家医保乙类目录。据摩熵医药跨国药企销售数据显示,在2023年武田制药的该马立巴韦片的全球销售额达191亿日元。
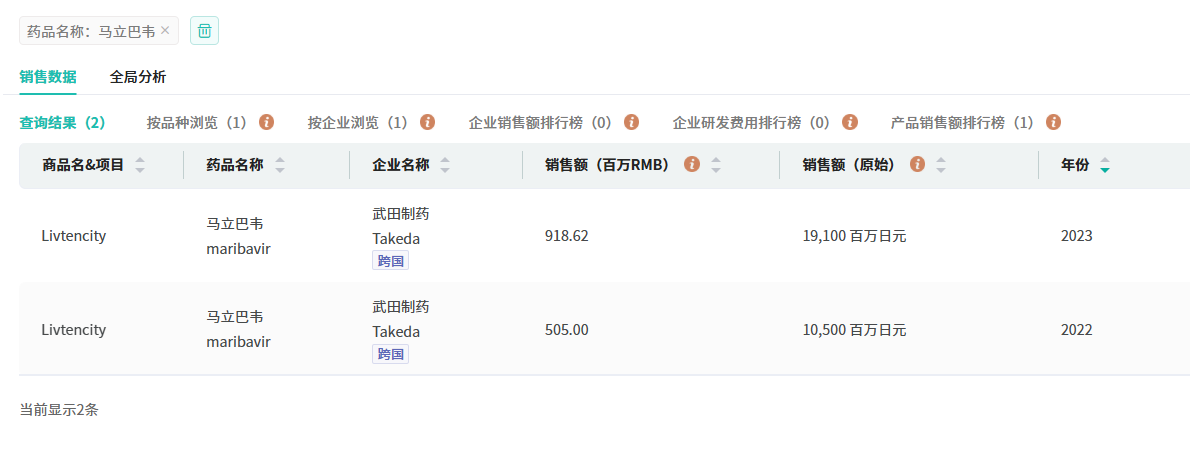
截图来源:摩熵医药跨国药企销售数据
马立巴韦已在美国、欧洲、韩国和澳大利亚获得孤儿药资格认定,分别于2021年11月获得FDA批准上市,于2022年11月获得欧盟委员会(EC)批准上市。目前,马立巴韦在国内除原研,暂无国内药企拥有生产批文。
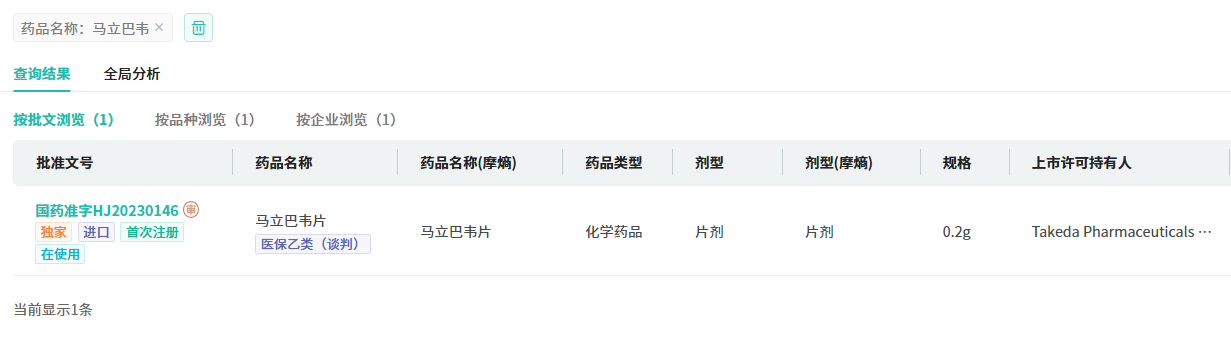
截图来源:摩熵医药中国药品批文数据库
在仿制药布局方面,马立巴韦片已有江苏奥赛康药业、桂林南药股份有限公司、齐鲁制药(海南)有限公司3家药企提交了马立巴韦片的上市申请,均获受理。此次,若齐鲁制药(海南)能顺利获批,将有望拿下马立巴韦片的国内首仿,从而在市场竞争中占据先机。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论