
12月18日,礼来宣布,该公司1类新药donanemab注射液上市申请已获得NMPA批准,用于治疗成人因阿尔茨海默病(AD)引起的轻度认知功能障碍和阿尔茨海默病轻度痴呆。

截图来源:礼来
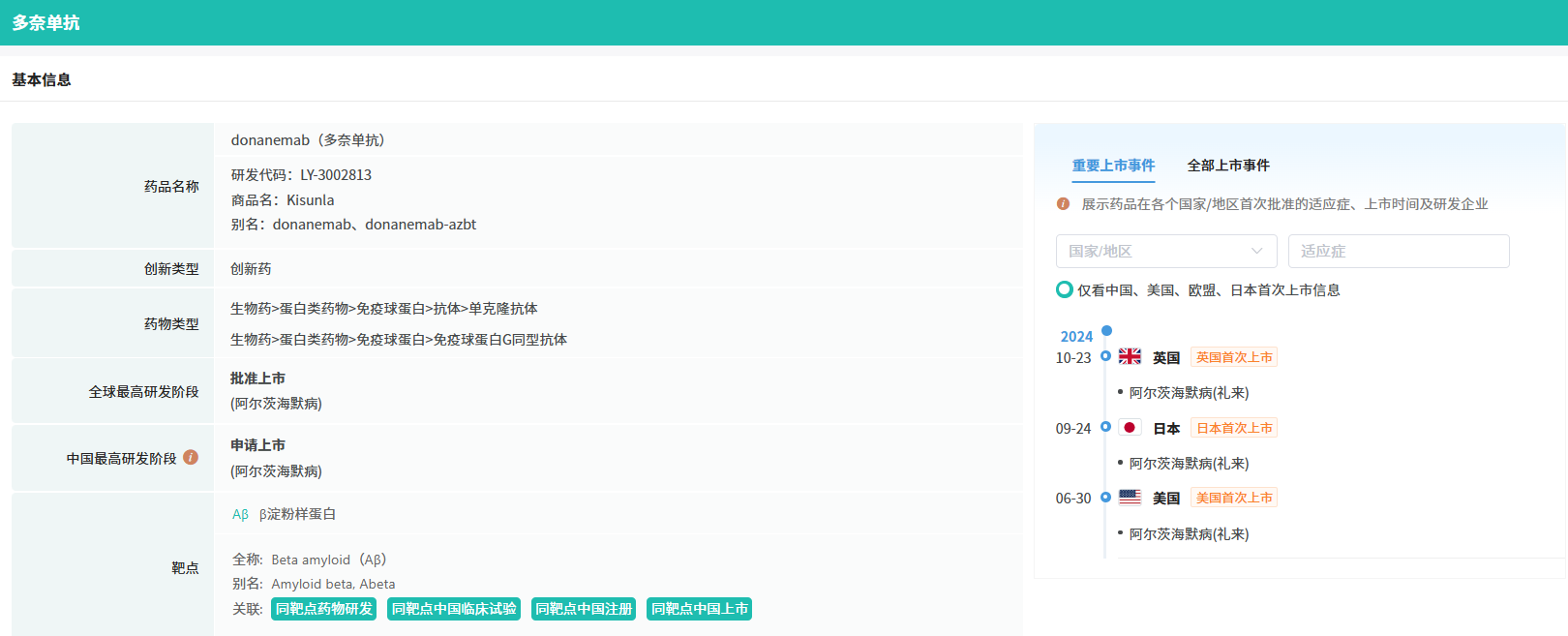
Donanemab是一种用于静脉输注的药物,每四周注射一次。该产品已经于2024年7月获美国FDA率先批准,用于治疗出现早期症状的阿尔茨海默病成年人(商品名:Kisunla)。在美上市仅 5 个月后,全球第二款 AD 新药登陆中国,同时它也是第一款且唯一一款有证据支持,在清除淀粉样蛋白斑块后可停药的靶向淀粉样蛋白的疗法。
截图来源:摩熵医药数据库(全球药物研发数据库)
该药此前入选了行业媒体Evaluate选出的“2024年十大潜在重磅研发管线”榜单。此外,礼来此前新闻稿表示,donanemab是首个有证据表明在淀粉样斑块清除后可停止治疗的淀粉样斑块靶向疗法,因此预计该疗法可以降低治疗成本并减少输液次数。
2023年7月,礼来公司正式揭晓了其III期研究的全面数据,这些数据表明,针对早期症状性阿尔茨海默病(AD)患者,该公司研发的药物能明显延缓其认知及功能上的衰退速度。

clinicaltrials.gov 截图
2024年10月,礼来再次传来喜讯,其TRAILBLAZER-ALZ 6临床3b期研究已成功达到主要试验目标。在为期24周的试验中,采用优化后的donanemab给药方案,早期症状性AD成年患者发生水肿/渗出相关的淀粉样蛋白相关成像异常(ARIA-E)的风险显著降低,相较于标准给药方案,风险降低幅度达到了41%。值得注意的是,在携带载脂蛋白E(APOE4)纯合子——这一已知的阿尔茨海默病高风险遗传因子——的患者中,优化方案的效果更为显著,ARIA-E的相对风险降低了67%。同时,优化后的给药方案在清除患者脑内的淀粉样蛋白斑块和降低血浆P-tau217水平方面,与标准方案的效果相当。礼来公司计划将这些重要数据提交至全球各大监管机构,以期对donanemab的药物标签进行更新。
截图来源:摩熵医药(原药融云)数据库
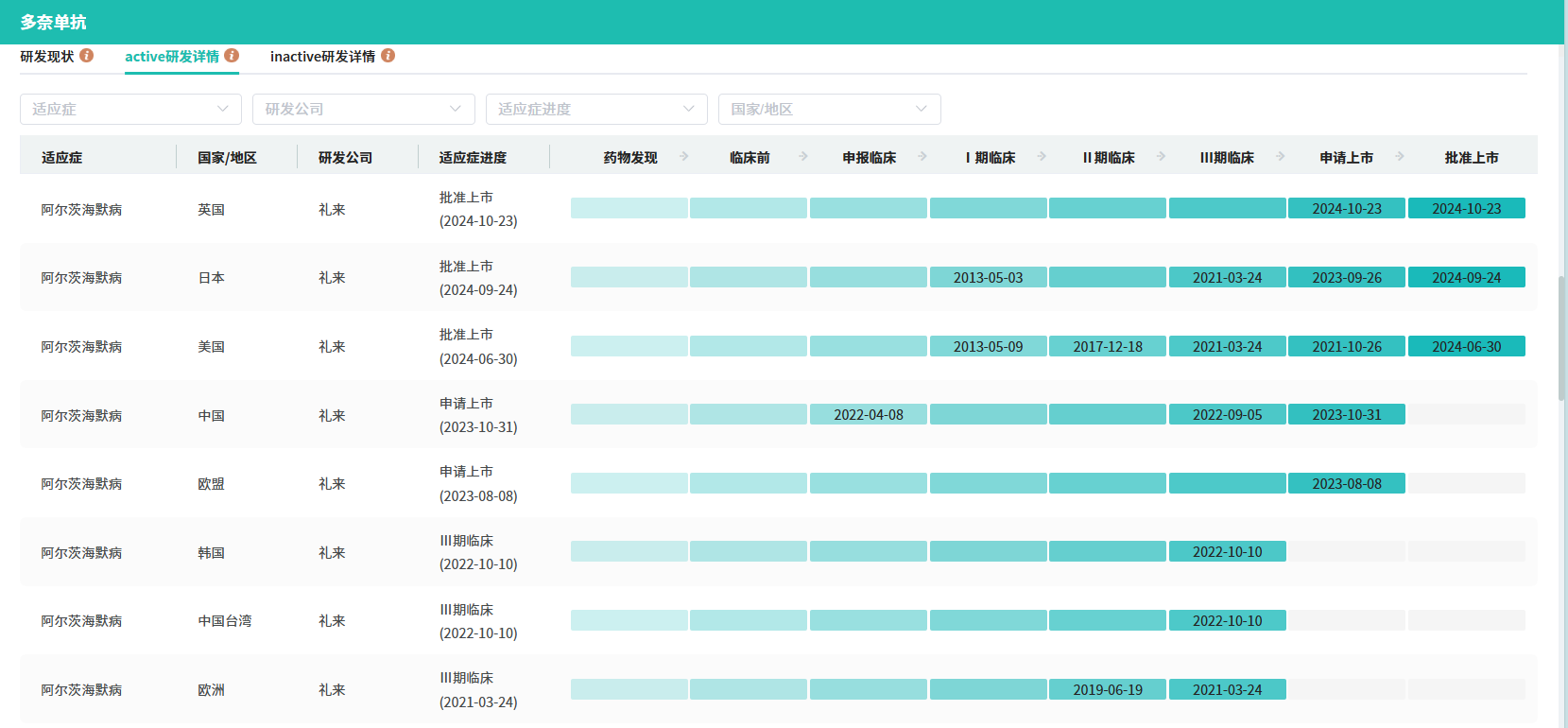
在中国市场,礼来也在积极推进donanemab的研发进程。此前,该公司已完成了一项针对中国健康受试者的donanemab1期研究,评估了其安全性、耐药性和药代动力学特性。2022年9月,礼来又启动了TRAILBLAZER-ALZ 5国际多中心、随机、双盲、安慰剂对照3期研究,这是一项在中国和韩国进行的针对早期症状性阿尔茨海默病的注册试验,旨在评估donanemab在存在脑tau蛋白病理的早期症状性阿尔茨海默病患者中的安全性和有效性。目前,该研究正在进行中,并计划在中国招募400名受试者。
据公开资料显示,除了礼来的donanemab注射液外,还有多款针对阿尔茨海默病的新药正在中国进行临床研究,这些药物的作用机制各不相同,包括乙酰胆碱酯酶抑制剂、M1/M4毒蕈碱乙酰胆碱受体激动剂、抗β淀粉样蛋白(Aβ)抗体、靶向Aβ的小分子新药以及TAAR1/5-HT2CR双靶点激动剂等。
参考来源:
[1] 礼来官方披露
[2] 摩熵医药(原药融云)数据库
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论