
近年来,由于生活水平的提高、生活方式和饮食结构的变化,非酒精性脂肪性肝病(NAFLD)的患病率不断增高。目前,非酒精性脂肪性肝炎(NASH)在NAFLD中所占比例为10%~30%,从2010到2021年,我国非酒精性脂肪性肝病诊疗指南中的数据增加了10%,由此可以估计增加了约2000万的NASH患者。
据全球肝脏研究所数据显示,预计到2030年,全球将有3.57亿人的生活受到NASH的影响。NASH是NAFLD的进展阶段,最终发展为终末期肝病和肝细胞癌,在美国被认为是导致成人肝硬化的主要原因之一,也是肝移植的主要原因。
NASH与肥胖、胰岛素抵抗、2型糖尿病、高脂血症等代谢紊乱关系密切,好发于中年特别是超重肥胖个体,其临床表现为脂肪性肝炎、脂肪性肝硬化。随着全球肥胖症的流行,NASH患者的临床和经济负担将变得巨大。

一、非酒精性脂肪性肝炎(NASH)的发病机制
NASH的发生、发展是一个动态变化的过程,病因复杂且受到饮食、环境、代谢、遗传、基因多态性等诸多因素的影响,发病机制尚不完全明确。在1998年提出NASH发病机制的“二次打击”学说:脂肪累积和变性是第一次打击,暴露于炎症因子和代谢副产物是第二次打击,最后导致细胞死亡、炎症和纤维化。
但是随着临床和基础研究的深入,人们发现“多重平行打击”理论能更好的阐述NASH的发病机制,这些打击因素包括:胰岛素抵抗、氧化应激、激素失调、慢性炎症、纤维化、免疫和肠道菌紊乱等,涉及肝脏、肠道和脂肪组织中的各种细胞。
肝活检是诊断NASH的金标准,组织学检查显示肝脂肪变性超过5%、肝细胞肿胀变性和肝小叶发生炎症,可以做出NASH的诊断。肝纤维化的严重程度是唯一独立预测NAFLD患者发生肝脏相关疾病、肝移植和与肝脏相关死亡的组织学因素。因此,准确的肝纤维化分期非常重要。
NASH肝纤维化5个阶段
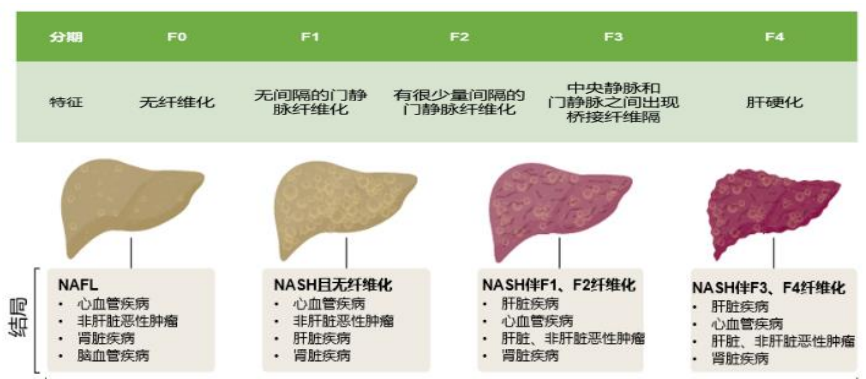
肝纤维化共可以分为5个阶段(F0-F4),定义为:无纤维化(F0);汇管区少量纤维化,无间隔纤维化(F1);汇管区纤维化,轻度间隔纤维化(F2);形成桥接样纤维化(F3);肝硬化(F4)。从病程上来看,NASH起病较为隐匿,同时纤维化的进展较为缓慢(平均7-10年进展一个等级)。不同阶段NASH患者的理想治疗方案不同。
无纤维化(F0)或纤维化可忽略(F1)的NASH,建议通过改变生活方式进行控制和治疗。一旦发生F3或F4期纤维化,则与肝脏相关的疾病和死亡风险显著增加,需要进行密切随访并对脂肪性肝炎、肝脏纤维化和合并的代谢性疾病进行治疗,但生活方式干预仍可作为其治疗措施的重要组成部分。
二、非酒精性脂肪性肝炎(NASH)新药研发现状
目前来看,NASH的新药研发失败现象如“家常便饭”:除了印度药企Zydus-Cadila Group开发的saroglitazar magnesium获批上市(目前仅在印度市场获批,该药NASH适应症在美国尚处于2期临床阶段)外,并无其他针对性药物获批,NASH仍存在巨大的治疗空白。所以临床上迫切需要NASH治疗药物,NASH药物研发还有很长一段路要走。
据药融云全球药物研发数据库统计,目前全球共有435个NASH在研药物,涉及300家企业,其中国IND以上研发阶段的药物共计201个,占比达到46%。NASH在研药物可以简单的分为以下四类:
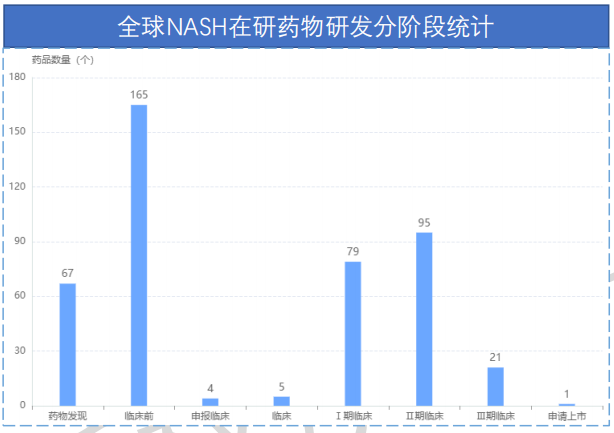
图片来源:药融云全球药物研发数据库
(1)调节新陈代谢紊乱:改善对胰岛素的敏感性,抑制参与脂肪生成的酶,涉及FXR、ACC、PPAR、GLP-1等靶点。2020年6月,FDA拒绝了Intercept Pharmaceuticals旗下药品甾体FXR激动剂奥贝胆酸(OCA)的上市申请,理由为FDA认为中期组织学终点数据带来的获益仍具有不确定性。2022年7月,OCA在一项关键临床3期试验中新的中期分析结果被公布。这项试验主要是检验OCA对NASH引起的肝纤维化病患的疗效。结果显示,OCA在意向性治疗(ITT)人群中有22.4%达成试验主要终点,即在第18个月时,其纤维化程度至少改善一个阶段且NASH情况没有恶化,而Intercept也会据此结果再次提交OCA的新药申请。
(2)调节炎症级联反应:抑制炎症细胞募集或阻断验证信号传导,涉及ASK1、CCR、NLRP3、Caspase、TLR4等靶点。Cenicriviroc是一种CCR2/CCR5双重拮抗剂,在Ⅱb期临床试验中,应用Cenicriviroc治疗1年后,受试者肝纤维化程度改善,且NASH未恶化的人数增加了两倍。

图片来源:药融云全球药物研发数据库
(3)抑制肝纤维化:直接针对肝星状细胞的抗纤维化靶点,减少肝脏中胶原蛋白沉积,涉及LOXL、Gal-3等靶点。MN-001(tipelukast)可以下调促进纤维化基因如LOXL2,collagen type I和TIMP-1的表达。MN-001在NASH和有高甘油三酯血症的NAFLD中的2期临床试验取得重要积极结果,结果显示,其可以显着降低平均血清甘油三酯水平,在主要终点上由治疗前的260.1 mg/dL降到到治疗8周后的185.2mg/dL。
(4)调节肠道微生物,例如抗生素、益生菌和粪便微生物群移植都对NASH有一定的潜在治疗作用。然而各个生物信号通路相互交织,互为因果,所以单独的靶向某一靶点,常常会出现疗效不足但产生各种副作用的现象,这也成为了NASH药物研发的一大难点。例如:ACC抑制剂在临床研究中能有效降低肝脏脂肪含量,但却意外升高血浆甘油三酯,带来了心血管安全隐患;PPARγ激动剂如罗格列酮能够改善胰岛素敏感性,但却显著增加体重。
非酒精性脂肪性肝炎药物临床进展
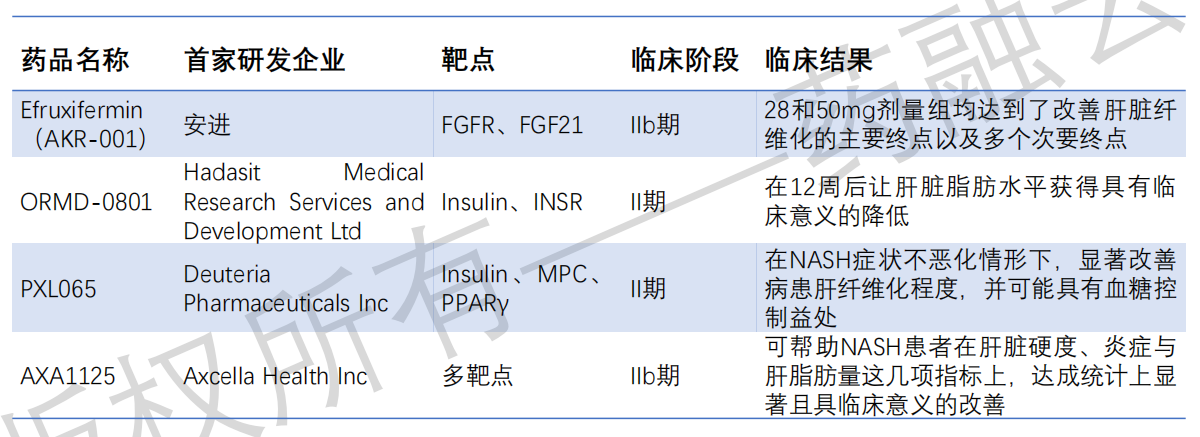
数据来源:药融云全球临床试验数据库
除了上述单一靶点外,发病机制复杂,诊断困难,临床试验缺乏可靠的、无创的终点等问题,提高了NASH药物的临床失败率,阻碍了NASH新药的研发进展。但由于全球NASH患病人群呈上升趋势,市场空间巨大,据Evaluate Pharm预测,全球2025年全球NASH药物的市场规模可达400亿美元,并且随着近期临床试验积极结果的不断发布,NASH药物研发热度不断升温,NASH在研药物后续是否能够成功上市?让我们拭目以待。
<END>
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论