又一起“NewCo模式”出海交易诞生。
2024年11月7日获悉,南京维立志博生物科技股份有限公司(下称“维立志博”)与风险投资公司Aditum Bio(下称“Aditum”)宣布基于维立志博全球首创CD19xBCMAxCD3三特异性T细胞衔接器抗体LBL-051成立新药研发公司Oblenio Bio(以下简称“Oblenio”)并达成了独家选择权及许可协议。Aditum 将为Oblenio提供资金,双方将合作迅速推进LBL-051进入临床研究。
根据协议条款,维立志博将授予Oblenio在全球范围内开发、生产和商业化LBL-051的独家选择权和许可,并有权获得3500万美元(约2.4亿人民币)的首付款和近期付款,在达成开发、监管注册、销售里程碑事件后,维立志博还将有权获得最高达5.79亿美元的总交易额款项,以及未来产品的销售分成。此外,维立志博还将有权获得Oblenio的股权。
全球首创抗体疗法
维立志博在南京生物医药谷建立了完整高效的抗体药开发平台,包括工艺(细胞培养、蛋自纯化和制剂工艺)开发,分析方法开发,质量控制以及中试原液生产。符合GMP和cGMP的中试原液生产平台,配备Cytiva的50L/200L/500L一次性生物反应器和纯化设备可灵活调整生产规模,满足临床前药理毒理试验、IND申报及I/I期临床试验用的供试品需求。CMC团队可支持和承担临床前CMC开发、中试GMP生产、技术转移、全球IND注册申报资料准备、工艺表征、工艺验证及BLA注册申报等工作。
凭借对分子机理及疾病生物学的深刻理解,维立志博开发了一系列针对不同靶点、作用机制及模式的专有技术平台,提供了大量抗体设计、筛选及开发工具及技术,使维立志博能够设计出具备高度特异性的定制药物资产,以满足各种适应症的临床需求。
其主要技术平台主要包括两个T细胞连接器平台:LeadsBody™平台(CD3 engager平台)及X-body™平台(4-1BB engager平台),以及其他双特异性抗体及抗体融合蛋白平台。
为了在T细胞连接器的安全性及有效性之间实现最佳平衡,维立志博开发了专有的LeadsBody™平台,该平台能够促进对CD3靶向双特异性抗体的分子设计进行多种修改。该等关键修改包括(其中包括)与肿瘤相关性抗原(TAA)结合的可变表达水平、结合不同细胞因子释放征调CD3亲和力、肿瘤微环境中的有条件T细胞复位向及激活机制以及不同的空间结构。通过利用该平台技术,维立志博用于治疗实体瘤及血液瘤的多种CD3靶向双特异性T细胞连接器(例如LBL-034及LBL-033)在临床前研究中表现出强大的抗肿瘤效果及良好的安全性。
此次交易的管线LBL-051是应用维立志博自主研发并具有知识产权的技术平台LeadsBody™开发的新型三特异性T细胞衔接器,其每个靶标CD19、BCMA、CD3的结合域均经过精心设计与优化,以实现疗效与安全性的最佳平衡。
CD19和BCMA靶向疗法的最新临床数据已证明其在难治性自身免疫疾病中具有良好的疗效,然而,在提升疗效和持久缓解方面仍存在未满足的临床需求。LBL-051通过同时靶向CD19和BCMA,有望在多种抗体介导的自身免疫性疾病中清除更广泛的病理性B细胞,从而激发更强效且持久的疗效。
为CD30双抗带来更多可能性,最快进展为2期

同样基于LeadsBody™的创新双抗LBL-034似乎更能展示维立志博技术平台亮点。
2024年11月1日,维立志博拥有全球知识产权的1类新药LBL-034获美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗多发性骨髓瘤(MM)。
LBL-034是应用维立志博自主研发并具有知识产权的CD3双抗技术平台“LeadsBodyTM”开发的新一代靶向GPRC5D及CD3的人源化双特异性T细胞衔接抗体,是全球第三个进入临床阶段的靶向GPRC5D的CD3 T细胞连接器。LBL-034仅在GPRC5D+细胞存在时选择性地与T细胞结合,从而在GPRC5D表达的肿瘤微环境中条件性地激活T细胞。在高、中及低GPRC5D表达的细胞中,LBL-034始终表现出优异的靶向肿瘤细胞杀伤作用,以及强大的剂量依赖性抗肿瘤活性,显示有成为同类抗肿瘤药最佳选择的潜力。
LBL-034于2023年7月分别在中国和美国获准开展临床研究,并于2023年11月在中国启动了在复发/难治性多发性骨髓瘤(RRMM)患者中开放标签、多中心、剂量递增/扩展的I/II期研究。这项由北京大学人民医院路瑾教授牵头、多中心参与的临床研究展现了良好的安全性和有效性。
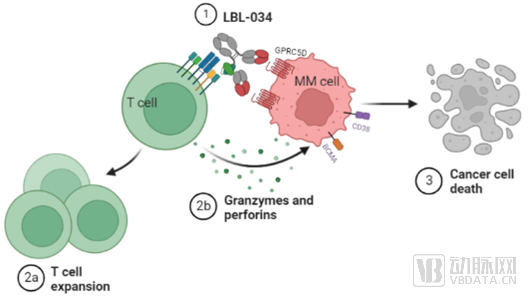
总体而言,维立志博的CD3双抗设计,给予了CD3双抗的另一种可能,一方面,减弱非TAA依赖的非特异性激活所引起的毒性,并利用多价设计,提高TAA端的结合交联能力,这样的设计增强了抗体的安全性,同时也提高了药效。
维立志博创始人、董事长、CEO康小强博士表示:“LBL-051为某些自身免疫性疾病提供了一种差异化的治疗选择,有望成为“Pipeline in a Product”的重磅革命性药物,我们很高兴能与Aditum 的高水平团队合作,将这一创新疗法带给全球患者。”
Aditum 联合创始人兼董事总经理Joe Jimenez表示:“与单靶点疗法相比,LBL-051通过同时靶向CD19和BCMA,旨在实现“免疫重置”,为自身免疫性疾病患者提供了更深层次的应答和更持久的疗效。”





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论