
近期,在美国召开的全球肺癌大会(WCLC)上,全球3000多名肺癌顶级专家与会,一款中国研发的治肿瘤新药依沃西注射液(AK112),会上获得潮水般的热烈掌声。
依沃西的“头对头”三期临床实验效果,击败当下全球“药王”——美国K药(默沙东的帕博利珠单抗)。K药2023年全球销售额高达250亿美元,其在免疫治疗领域有神一般的地位,美国食品药品监督管理局(FDA)批准了约40个适应症上市,几乎只要涉及免疫治疗,标准疗法就有K药。
迄今,依沃西单抗是全球首个且唯一在III期单药"头对头"临床研究中证明疗效显著优于K药的药物。这意味着依沃西有望挑战K药单药在治疗PD-L1 高表达NSCLC 患者的一线地位,成为下一代免疫治疗基石药物,进一步拓展"去化疗"方案适用人群,具有划时代意义。
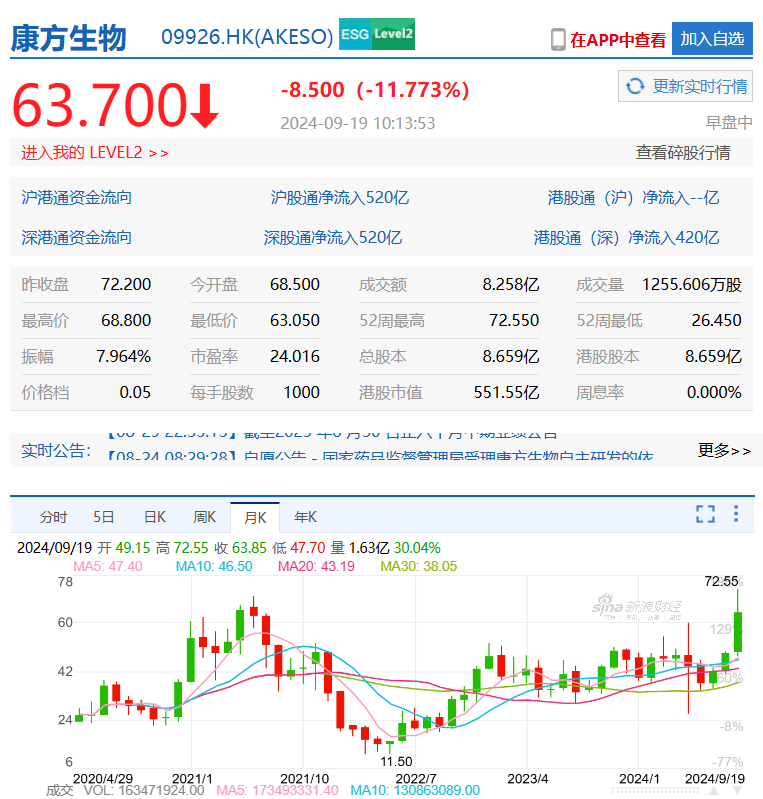
同时,依沃西的原研厂商康方生物及合作伙伴Summit Therapeutics受此消息影响,股价大涨。
从年内低点算起,康方生物股价三个月涨幅超过了270%,市值暴涨396 亿港元;如果从历史最低位算起,该公司两年股价涨幅超过了600%,超越了2021年的高点。
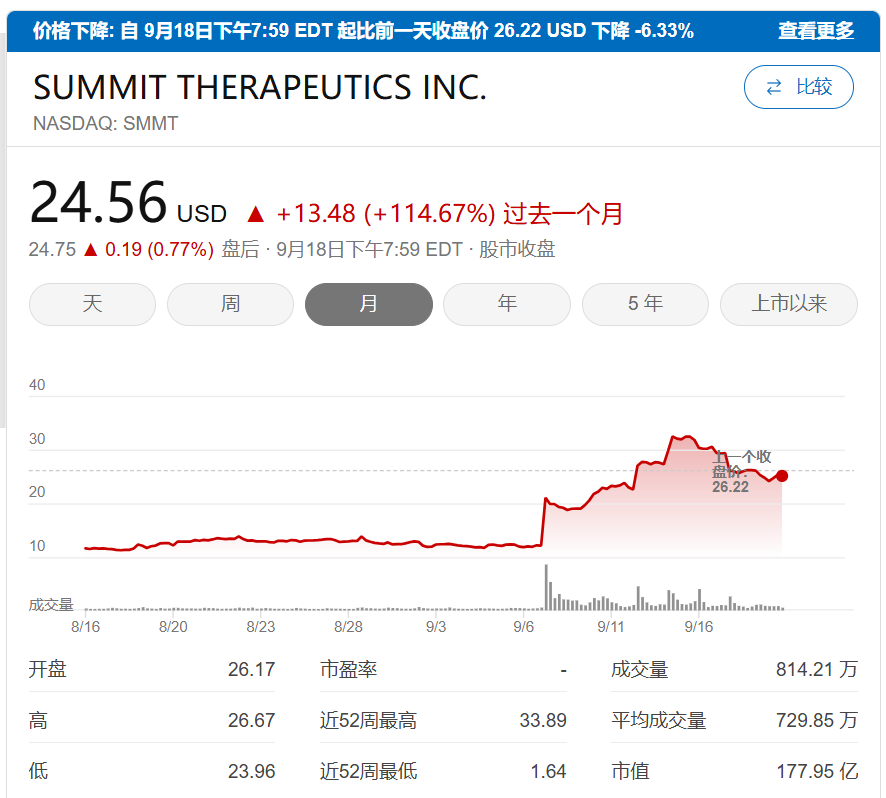
海外合作方Summit Therapeutics Inc.(SMMT 纳斯达克)4个月内股价上涨12倍,市值达231亿美元(约1800亿港元)。
不过,一些分析人士敦促谨慎行事,因为这些数据仅来自中国的试验。
BMO Capital Markets分析师Evan Seigerman表示,除了最初评估的以中国为重点的患者群体外,其结果可能会推广,也可能不会推广。因为基于FDA的考虑可能需要美国的数据。
Mark癌症研究基金会的CEO Ryan Schoenfeld表示,现在就对依沃西NSCLC的数据感到兴奋还为时过早。尽管检查点抑制剂改变了肺癌患者的曲线,但仍有很多患者的需求得不到满足,并且,有理由认为依沃西可能与K药联合化疗相比具有竞争力,有可能使患者免于化疗,而化疗会带来疲劳、恶心和血细胞计数低等一系列副作用。
MD安德森癌症中心专门从事NSCLC研究的Heymach实验室负责人John Heymach表示同意,无论以何种标准衡量,这些数据都令人印象深刻。
有待证明:总体生存率
MPM BioImpact的联合管理合伙人Christiana Bardon表示,Summit的数据是权威的,但他们缺乏试验结果总生存期(OS)。Summit在其新闻稿中表示,OS数据尚不成熟,将在未来进行评估。
Heymach表示,虽然无进展生存期(PFS)的改善有时不能转化为OS的改善,但鉴于PFS获益的幅度,如果这一结局指标没有反映出来,那将是令人惊讶的。
Summit可能还需要证明治疗指数的改善,这可以通过将抗VEGF和抗PD -1作为单独的治疗药物联合使用来实现。根据Summit的说法,依沃西不仅仅是将两种疗法结合在一起。双特异性抗体具有独特的协同结合,在PD-1和VEGF存在时具有更高的亲和力。
需要多样化的数据
鉴于目前的结果仅来自于中国的试验,FDA 需要看到来自不同人群的更多数据才能考虑批准。仅使用中国的数据可能会因遗传学差异、患者随访较少以及报告副作用的文化差异等因素而产生偏差。
Bardon 强调,在审查仅限中国的数据时,安全性以及副作用可能是 FDA考虑 的一个问题。例如,在 HARMONI-2 中,3 级不良事件很少。与我们在西方人群中看到的情况相比,不良事件可能被低估了。
如果这些数据确实在更广泛的人群中站得住脚,Summit 可以分得 K药总年250 亿美元销售额的一部分。虽然康方生物已经在其持有权利的中国获得了依沃西单抗的批准,但 Summit 的许可能延伸到美国、加拿大、欧洲、日本、中美洲、南美洲和少数其他市场。
总结
康方生物/Summit 并不是唯一一家最近宣布了积极结果的双特异性开发者。BioNTech在ESMO 2024上报告称,其自身的双特异性靶向PD-L1和VEGF-A的BNT327在64名中国egfr突变型NSCLC患者的II期试验中获得了57.8%的证实客观缓解。与此同时,insil Bio及其在中国的合作伙伴ImmuneOnco biopharmacmac 正准备开始一项针对非小细胞肺癌和三阴性乳腺癌的双特异性抗体SYN-2510/IMM2510的II期试验。
双特异性抗体治疗时代已经到来。
参考资料:www.biospace.com
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论