
9月10日,浙江华海药业发布公告,公司向美国FDA申报的白消安注射液新药简略申请(ANDA)已获得批准且获得孤儿药认定。据药融云数据库显示,白消安注射液在2023年全国院内市场的销售额超6亿元。

截图来源:企业公告
白消安注射液原研由 OTSUKA PHARMACEUTICAL CO LTD 研发,主要用于与环磷酰胺联合使用,作为慢性粒细胞白血病异基因 造血祖细胞移植前的预处理方案。于1999年2月在美国上市。据IQVIA数据显示,2023年白消安注射液在美国市场销售额约343万美元。据药融云数据库显示,白消安注射液在2023年全国院内市场的销售额超6亿元。
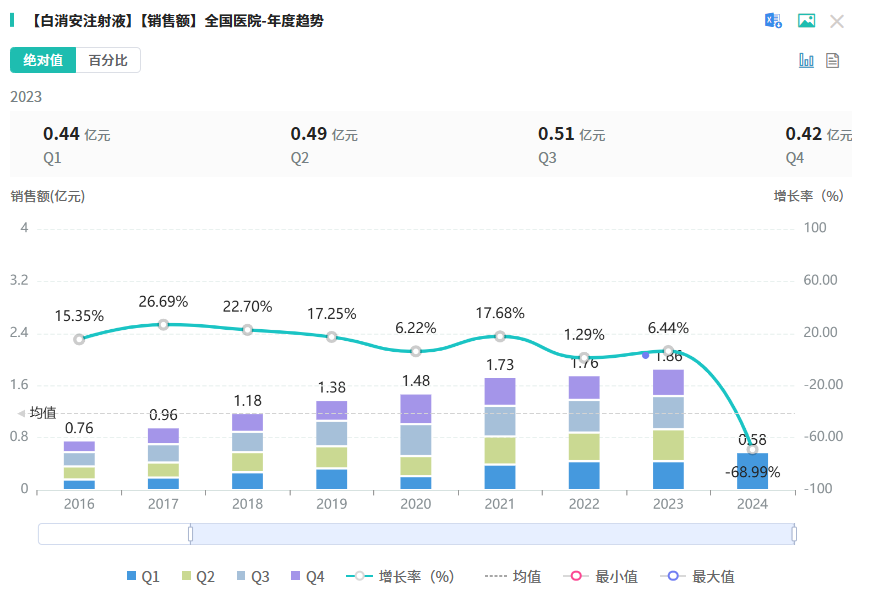
截图来源:药融云全国医院销售数据库
截至目前,华海药业在白消安注射液美国研发项目上已投入研发费用约760万元人民币。据药融云数据库显示,白消安注射液有5家企业拥有生产批文,健进制药、浙江华海药业和华润双鹤药业3家药企过评。

截图来源:药融云过评药品汇总数据库
本次白消安注射液获得批准,标志着华海药业具备了在美国市场销售上述产品的资格,有利于公司不断扩大美国市场销售和强化产品供应链,丰富产品梯队,提升公司的品牌知名度及市场竞争力。
参考来源:
[1] 浙江华海药业官方公告
[2] 药融云数据库
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论