
近日,君实生物(688180)发布2024年财报,公司实现营业收入19.48 亿元,同比增长29.67%,扣非净利润-12.90亿元,EPS为-1.30元;研发费用支出12.75亿元,同比减少34%;目前A股市值近300亿元。
2024年度,重磅PD-1单抗产品拓益实现国内市场销售收入15.01 亿元,同比增长约66%,得益于公司商业化团队销售效率提升,特瑞普利单抗获批适应症及纳入国家医保目录适应症的增加。根据公司的美国合作伙伴 Coherus 发布的2024初步收入,特瑞普利在美国的销售额:Q1为190万美元,Q2为380万美元,Q3为580万美元,方正证券预计Q4为700-800万美元,美国市场销售也是逐季向好。
截至报告期末,公司已拥有特瑞普利单抗注射液(商品名:拓益)、阿达木单抗注射液(商品名:君迈康)、氢溴酸氘瑞米德韦片(商品名:民得维)和昂戈瑞西单抗注射液(商品名:君适达)四款商业化药品。

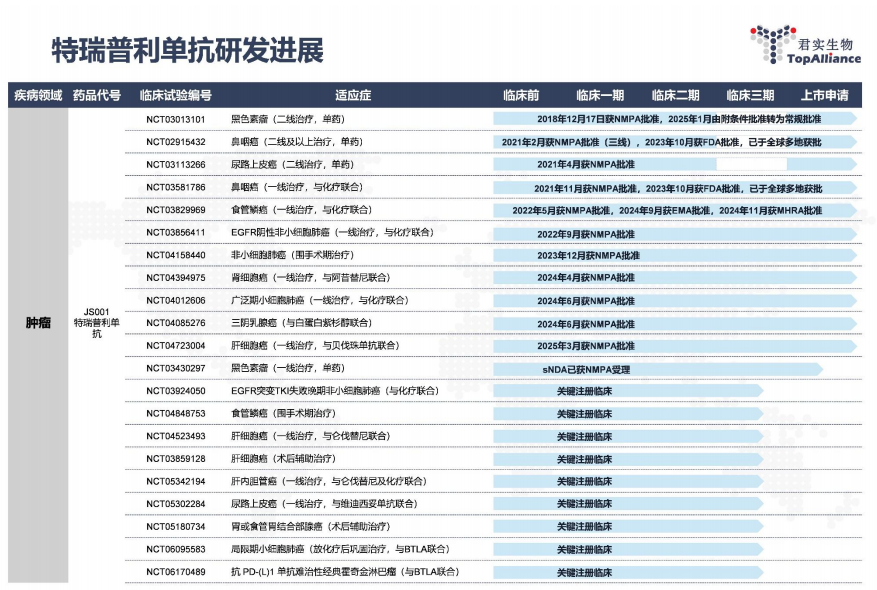
截至年报披露日,拓益已在中国内地获批11项适应症,其中多项为公司独家或领先适应症。2024年1月起,拓益®新增一线治疗鼻咽癌、一线治疗食管鳞癌、一线治疗非鳞状非小细胞肺癌 3 项适应症纳入国家医保目录(2023年),2024年11月,拓益®新增非小细胞肺癌围手术期治疗、晚期三阴性乳腺癌一线治疗、晚期肾细胞癌一线治疗及广泛期小细胞肺癌一线治疗的 4 项适应症纳入国家医保目录(2024 年),目前已有10项获批适应症纳入国家医保目录,是国家医保目录中唯一用于黑色素瘤、非小细胞肺癌围手术期、肾癌和三阴性乳腺癌治疗的抗PD-1单抗,新版国家医保目录于2025年1月1日起正式实施。
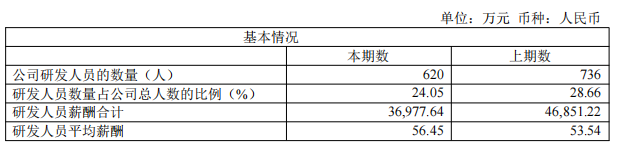
截至报告期末,公司拥有2,578名员工,其中620名员工负责药物研发;2024 年女性员工占比约52%。2024年公司研发人员薪酬合计支出3.7亿元,研发人员平均薪酬56.45万元,同比增长5%。
公司建立了涵盖蛋白药物从早期研发到产业化的整个生命周期的完整技术体系,该体系包括多个技术平台:
(1)抗体筛选及功能测定的自动化高效筛选平台
(2)人体膜受体蛋白组库和高通量筛选平台
(3)抗体人源化及构建平台
(4)高产稳定表达细胞株筛选构建平台
(5)CHO 细胞发酵工艺开发平台
(6)抗体纯化工艺及制剂工艺开发与配方优化平台
(7)抗体质量研究、控制及保证平台
(8)抗体偶联药研发平台
(9)siRNA 药物研发平台
(10)产业化放大与技术转移平台。
生产能力方面,公司在中国拥有两个单克隆抗体生产基地,分别位于苏州吴江和上海临港。苏州吴江生产基地拥有 4,500 升(9*500 升)发酵能力,已获得中国、美国及欧盟的 GMP 认证,现阶段美国、印度、中国香港等多地的商业化批次特瑞普利单抗由该生产基地负责生产。作为公司商业化产能的重要支撑,上海临港生产基地目前产能 42,000 升(21*2,000 升),已获得 NMPA的 GMP 认证,可与苏州吴江生产基地同时负责生产商业化批次的特瑞普利单抗注射液。由于规模效应,上海临港生产基地产能的扩充亦将为公司带来更具竞争力的生产成本优势,并支持更多在研项目的临床试验用药以及未来的商业化批次生产。
总结
自公司2012年12月成立至今,公司已开发超过50项在研药品。公司已有4款商业化药品,近30项在研药物处于临床试验阶段,超过20项在研药物处在临床前开发阶段。研发能力、商业化能力和国际化拓展能力持续得到验证。公司未来将加快特瑞普利单抗适应症扩展,以及在海外更多国家和地区的获批。同时也在积极探索包括 Claudin18.2 ADC药物、PI3K-α 口服小分子抑制剂、PD-1/VEGF双抗、CD20/CD3 双抗等产品在内的早期阶段管线,尽快推动更多优势产品和适应症进入注册临床试验阶段,为公司未来营业收入提供持续增长动力。
参考来源:
[1] 君实生物年报
[2] 方正证券
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论