
2024年美国临床肿瘤学会(ASCO)年会已于今日(当地时间5月31日)在美国芝加哥正式开幕。
在CAR-T领域,国产创新药正在突破血液瘤的桎梏,去到适应症更加广阔的实体瘤领域,科济药业的CT041、艺妙神州的实体瘤CAR-T产品IM96均入选了ASCO大会口头报告环节,此外还有由西比曼(AbelZeta Pharma)和阿斯利康在中国联合开发的装甲型自体CAR-T疗法C-CAR031。
艺妙神州:IM96
艺妙神州医疗自主研发的IM96是一款靶向GUCY2C(GCC)的CAR-T细胞疗法。根据此前艺妙神州在2023年欧洲肿瘤内科学会(ESMO)年会上公布的I期数据,在治疗晚期转移性结直肠癌患者的试验中,疾病控制率为66.7%,客观缓解率为11.1%,达到部分缓解的1例患者至今11个月仍持续缓解。安全性方面,所有入组患者未观察到神经毒性综合征和≥3级的细胞因子释放综合征。

实体瘤在研管线(图片来源:官网)
科济药业:CT041
CT041是一种潜在全球同类首创的、靶向Claudin18.2蛋白的自体CAR-T细胞候选产品,用于治疗Claudin18.2阳性实体瘤,主要治疗胃癌/食管胃结合部腺癌及胰腺癌。
5月28日,科济药业在国际肿瘤学顶级期刊《Journal of Clinical Oncology》发布CT041)治疗难治性转移性胰腺癌的最新临床研究成果。
该研究报告了两项多中心、开放标签的I/Ib期临床试验CT041-CG4006和CT041-ST-01的汇总分析结果,试验主要终点是评估CT041的安全性和耐受性,次要终点包括疗效、药代动力学和免疫原性。两项试验共入组24例晚期胰腺癌患者,其中5例患者(20.8%)既往接受过一线治疗,19例患者(79.2%)既往接受过至少二线治疗。
科济药业CAR-T研发管线

在疗效方面,24例患者中有12例观察到肿瘤靶病灶不同程度缩小,总体客观缓解率(ORR)为16.7%,疾病控制率(DCR)为70.8%,临床获益率(CR/PR+SD≥4个月)为37.5%。中位应答持续时间(mDoR)为9.5个月,12个月的DoR率为50%。中位无进展生存期(mPFS)为3.3个月,中位总生存期(mOS)为10.0个月,12个月时OS率为45.8%。在获得PR/SD的患者中,mPFS(6.0 vs 1.0个月,P < 0.001)和mOS(17.6 vs 4.0个月,P < 0.001)均较PD患者显著延长。
西比曼/阿斯利康:C-CAR031
C-CAR031,是一种靶向GPC3的装甲型自体CAR-T疗法。由西比曼(AbelZeta Pharma)和阿斯利康在中国联合开发。C-CAR 031是阿斯利康利用其转化生长因子β受体Ⅱ(TGFbRⅡ)显性负性装甲发现平台设计的一种新型靶向GPC3的CAR-T,由西比曼在中国生产。
此次入选是该产品用于肝细胞癌的Ⅰ期研究结果,这是C-CAR031的首次人体试验,纳入一线及以上系统治疗失败的GPC3+晚期HCC患者,在标准清淋后给予C-CAR031单次静脉输注。主要终点为安全性和耐受性,其他终点包括药代动力学和初步疗效。
共纳入24例患者,C-CAR031分为4个剂量水平(DL1,DL2,DL3,DL4)。所有患者均为BCLC C期HCC,83.3%(20/24)的患者伴有肝外转移。既往治疗线数中位数为3.5线(范围1~6线),23例(95.8%)患者接受过免疫检查点抑制剂(ICI)和酪氨酸激酶抑制剂(TKI)。
除了以上3款CAR-T疗法,还有另外3款细胞疗法,其中包括TCR-T疗法Lete-cel、TIL疗法OBX-115和细胞免疫疗法Bria-IMT(SV-BR-1-GM)也入选本次ASCO大会口头报告环节。
Adaptimmune:Lete-cel
lete-cel是一种针对滑膜肉瘤(SyS)和黏液样/圆形细胞脂肪肉瘤(MRCLS)高表达的NY-ESO-1癌睾丸抗原的自体工程化T细胞受体疗法。
lete-cel正在进行关键的IGNYTE-ESO试验(NCT03967223)的研究,中期分析:有18/45的患者有反应(ORR为40%),包括2例CR和16例PR。主要疗效终点要求16/60的患者有反应,因此该试验已达到其主要疗效终点,完整的关键分析预计将于2024年底完成。
Obsidian Therapeutics:OBX-115
OBX-115是一种新型的工程化TIL疗法,其独特之处在于TIL能够表达细胞膜上受调节的白介素-15(IL-15)蛋白,这意味着患者在接受OBX-115治疗时,无需同时接受高剂量的白介素-2(IL-2)治疗,从而降低了潜在的治疗毒性。
该产品目前正处于1/2期多中心研究阶段。入选口头报告的是一项1期研究结果,评估了OBX-115方案在ICI耐药、不可切除/转移性黑色素瘤患者中的疗效和安全性。
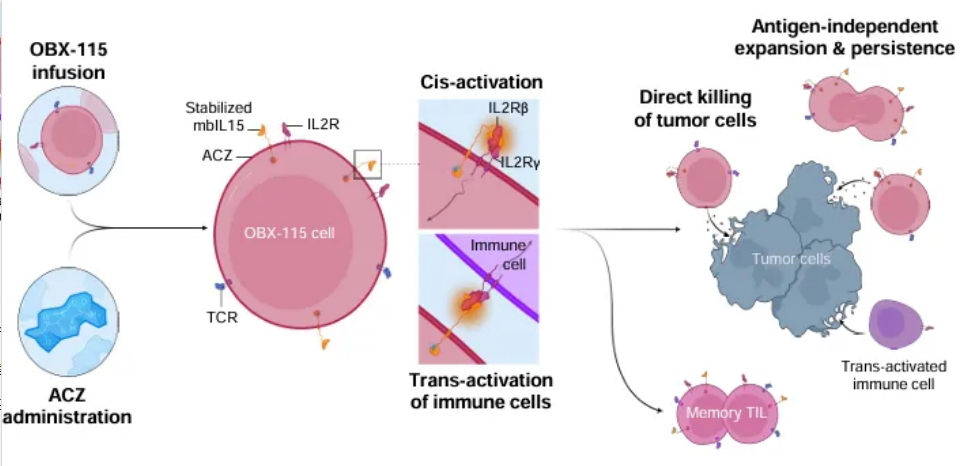
截至2024年1月2日,9名黑色素瘤患者接受了OBX-115输注,他们既往治疗的中位线为3。在至少12周随访的患者中(n=6),按RECIST v1.1计算的ORR为50%(2例CR,1例PR,3例SD);所有反应都发生在第6~18周之间,最长反应持续时间>12个月。研究人员认为,OBX-115治疗耐受性良好,产生持续加深和持久的反应,表明其可能介导无大剂量IL2的ICI耐药转移性黑色素瘤的完全缓解和持久的临床益处。
BriaCell:Bria-IMT
BRIA-IMT方案是一种使用同种异体全细胞癌症疫苗联合检查点抑制剂联合免疫疗法。皮内注射SV-BR-1-GM乳腺癌细胞分泌的GM-CSF并在HLA-I和HLA-II分子上呈递肿瘤相关抗原(TAA)以直接刺激抗肿瘤免疫。PD-1抑制剂进一步刺激T细胞并与SV-BR-1-GM发挥协同作用。本次报告了BRIA-IMT治疗转移性/晚期乳腺癌的I/II期试验结果,评估了SV-BR-1-GM接种和免疫检查点抑制剂治疗的顺序。
在接受SV-BR-1-GM 3期制剂治疗的23例患者中,客观缓解率(ORR)为13%,疾病控制率(DCR)为61%,中位PFS为4.1个月,中位OS为13.3个月。与替代序列队列相比,原始序列队列具有更高的DCR(36%vs43%)和OS(HR,0.30)。
研究结果显示,BRIA-IMT方案显示出良好的安全性,同时为接受重度治疗的晚期/转移性乳腺癌患者带来了临床益处。本试验为正在进行的III期试验奠定了基础,在III期试验中,将BRIA-IMT与标准治疗方法进行了比较,初步看到接受SV-BR-1-GM 3期制剂的患者得到了更好生存获益,也证实了新方案的疗效有所改善。
总结
2024年可以说是细胞疗法爆发的一年,2月,全球首款TIL疗法在美国获批上市,其用于治疗PD-1抗体治疗后进展的晚期黑色素瘤,打响了细胞治疗实体瘤的全球首枪。
在中国,细胞治疗行业发展也如火如荼,已与美国形成并驾齐驱之势。4月,传奇生物的CAR-T疗法Carvykti在欧盟获批用于二线治疗复发性或难治性多发性骨髓瘤(RRMM)成人患者。另外,4月有8款细胞疗法首次在国内获批临床,包括肿瘤浸润淋巴细胞(TIL)疗法、干细胞药物、γδ T细胞药物、CAR-T细胞药物、TCR-T细胞药物、CAR-raNK细胞疗法等多种形式。
参考资料:
https://conferences.asco.org/am/abstracts
各公司官网
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论