
3月18日,CDE临床试验登记平台最新信息显示,华东医药的双靶点长效多肽类激动剂HDM1005,旨在针对GLP-1R与GIPR,已正式开启首次临床试验(登记号:CTR20240892)。

截图来源:CDE
HDM1005,作为华东医药独立研发的1类新药,已于去年12月成功提交临床申请,并于本月11日获得批准,3月18日正式迈入临床试验阶段。

截图来源:药融云全球药物研发数据库
华东医药在代谢领域持续深耕,尤其以GLP-1靶点为核心,构建了卓越的糖尿病创新药物研发平台。该平台囊括口服、注射等多种剂型,包括长效与多靶点全球创新药及生物类似药,总计近10款与GLP-1及相关靶点相关的产品。依托现有管线的深厚积淀,华东医药继续挖掘与GLP-1相关靶点的创新潜能,拓展减重、降脂、NASH等适应症领域,致力于开发高生物利用度、更具临床价值的创新药物。
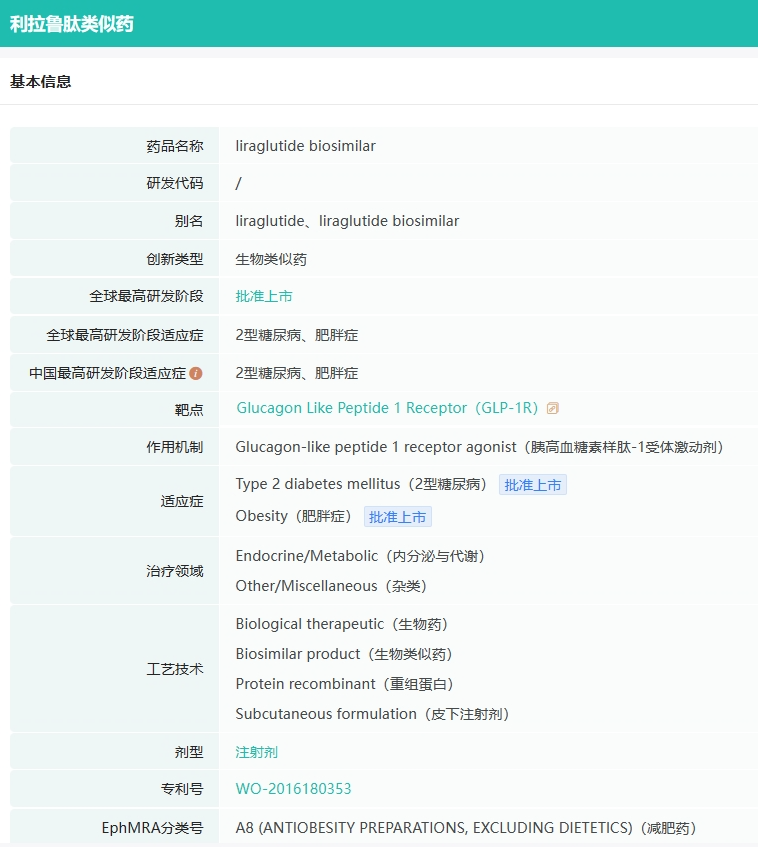
截图来源:药融云全球药物研发数据库
在生物类似药领域,华东医药亦取得显著进展。利拉鲁肽注射液的糖尿病及肥胖适应症已分别于去年获批上市,成为国内首家成功提交并获批两个适应症注册申请的企业。此外,司美格鲁肽注射液的I期临床已圆满完成,等效性研究终点顺利达成,并顺利推进至Ⅲ期临床研究。
在1类新药研发方面,华东医药积极引进国际先进技术。自日本SCOHIA引进的GLP-1R/GIPR双靶点激动剂SCO-094及其衍生产品,为治疗2型糖尿病、肥胖和MASH等疾病提供了新的治疗选择。同时,全球首个进入临床研究的三靶点激动剂DR10624,同时靶向GLP-1R、GCGR和FGF21R,已在肥胖症和体重管理领域取得重要突破。该药物于2023年7月在新西兰成功完成治疗肥胖症的I期多次递增剂量给药(MAD)临床试验的首例受试者给药,其国内针对超重或肥胖人群的体重管理临床试验亦于去年8月顺利启动。

截图来源:药融云全球药物研发数据库
此外,口服小分子 GLP-1 受体激动剂 HDM1002 同样在开展 I 期临床试验。展现出华东医药在创新药物研发领域的全面布局与深厚实力。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论