
9月17日,易慕峰,一家致力于突破实体瘤治疗的细胞治疗产品开发企业,宣布其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品(IMC001)近期获得美国食品和药物管理局(FDA)的孤儿药资格认定(ODD),用于治疗胃癌患者。
- 首个将EpCAM作为CAR-T靶点并公布临床试验数据的产品
- 获得美国孤儿药认定是对IMC001在胃癌治疗领域突出意义的认可
IMC001是靶向EpCAM的自体CAR-T产品。EpCAM是循环肿瘤细胞(CTC)的生物标志物,它在消化系统肿瘤的转移灶和原位灶中均表达高,而在正常组织中表达量较低;EpCAM在正常组织中表达在免疫细胞不易接触到的细胞基底侧面,而在肿瘤恶性转化过程中EpCAM表达模式转变为在细胞膜上均匀分布。基于EpCAM在正常组织和肿瘤组织间表达量和表达模式的差异,IMC001能够区分肿瘤组织和正常组织,具有良好的剂量窗口,且在临床前研究中显示出极具潜力的抗肿瘤活性。
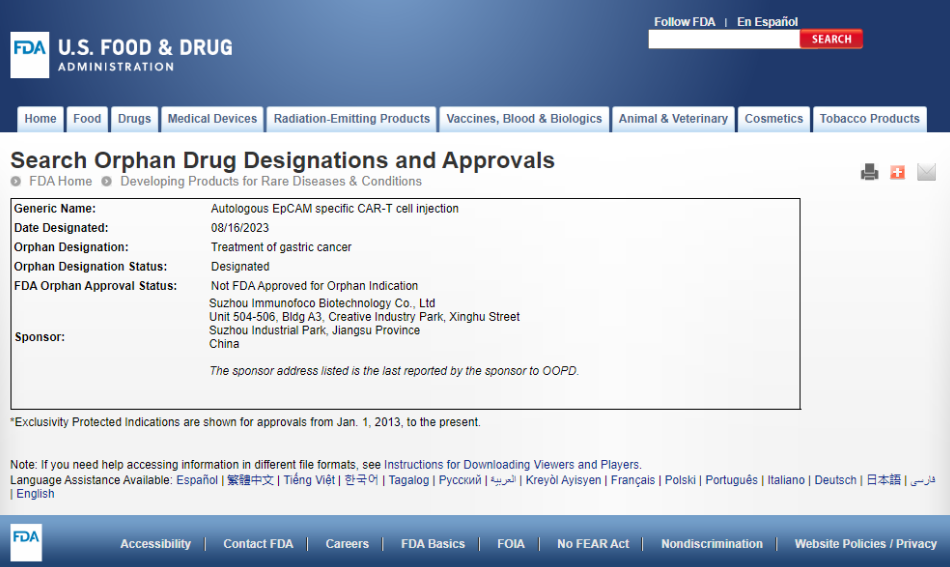
IMC001全球研发进度查询

截图来源:药融云全球药物研发数据库
为评估IMC001在晚期EpCAM+消化系统肿瘤的安全性和初步有效性,易慕峰已经进行了两项IIT临床研究。在针对晚期胃癌的临床试验中,中低剂量组6名晚期胃癌患者中有2名患者被评定为部分缓解(PR),中剂量组三例患者的存活时间均已超过10个月,其中1例PR患者在IMC001单药单次输注后28周成功进行了胃癌根治手术,安全性良好。
获得美国孤儿药认定是对IMC001在胃癌治疗领域突出意义的认可。孤儿药认定是针对罕见病或病人总数不超过20万的疾病的药物提供的特殊药物认可制度。这一认定将为IMC001的进一步研发和商业化带来诸多优势,以及获得由美国FDA提供的一系列优惠政策和支持,将为IMC001的落地提供了有力保障。
易慕峰创始人、董事长兼CEO孙敏敏表示:“非常高兴公司具有战略意义的产品管线取得了重大进展,这是今年公司获得的第三项ODD认证。IMC001是围绕公司化实体瘤为血液瘤策略下立项开发的产品,并在早期IIT中初步验证了这一策略的正确性,患者经过治疗可以控制住复发转移,并有长期生存获益的可能,以及有一例原本没有手术机会的患者成功转化成手术根治的状态。中国每年有约40万胃癌新发病人,有巨大的未满临床需求,且胃癌二线治疗药物已效果有限,二线复发后更是缺乏好的治疗手段。接下来,我们将继续推进IMC001的IND申报和临床研究,为患者提供创新的CAR-T细胞免疫治疗方案和更多治疗选择,旨在提高晚期胃癌患者的生活质量和延长其生存期。”
关于易慕峰
易慕峰是一家致力于突破实体瘤治疗,给患者带来长期生存获益的免疫细胞治疗药物开发企业。公司由科学家和产业精英合作组建,于2020年9月启动运营,核心成员成功推动了中国首个CAR-T药物的上市申请,具有丰富的细胞药物开发和产业化经验。
易慕峰从实体瘤治疗痛点和临床获益出发,在全球范围内首次提出“化实体瘤为血液瘤”的临床策略,并在此基础上开发了Peri Cruiser®技术平台,同时还开发了SNR、T-Booster等技术平台,旨在提高CAR-T产品的安全性、对抗肿瘤异质性以及提高扩增和浸润肿瘤的能力。公司始终以临床价值为导向,拥有丰富的产品管线,其中IMC002 IND申请已获得中美双批。公司秉承“众擎举易,同心执慕,勇攀高峰”的发展理念,集聚行业英才,携手开发能够给实体瘤患者带来长期生存获益的创新药物。
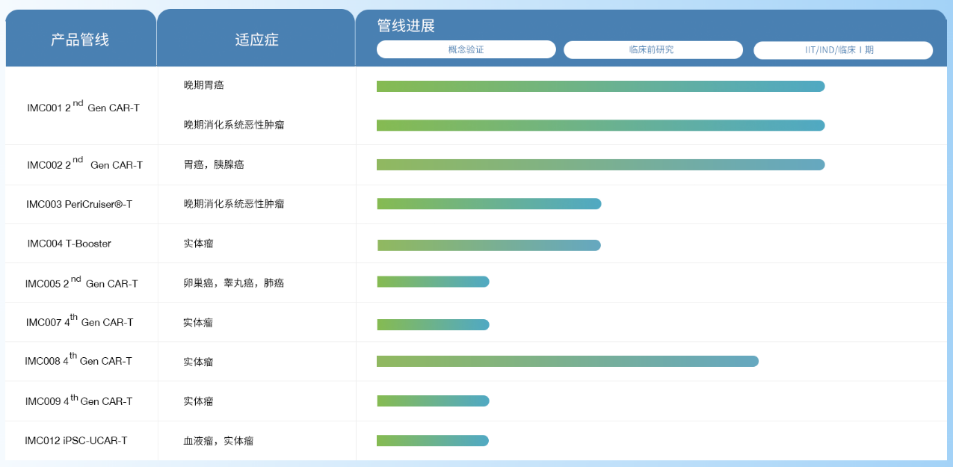
产品管线
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论