
8月7日,生物技术公司Krystal Biotech公布2023上半年业绩:净亏损7850万美元,折合人民币5.7亿元(1美元 ≈ 7.2569人民币),亏损同比扩大0.5%,其中研发费用2443万美元,同比增加20.9%,研发费用包括基于股票的补偿540万美元。
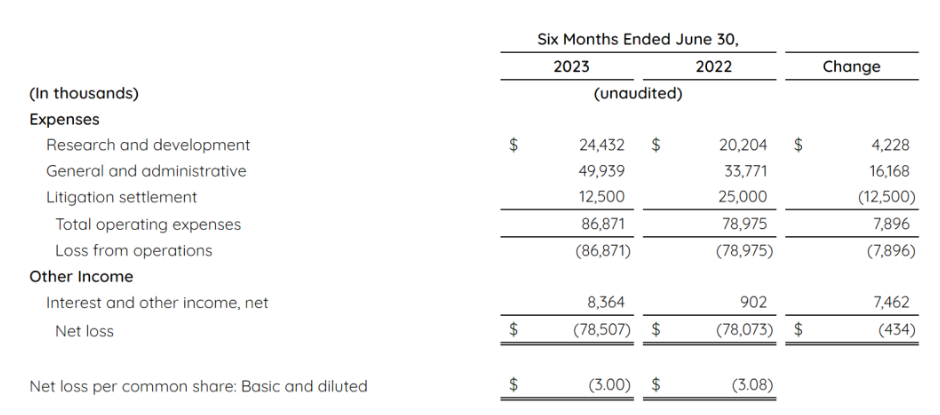
在首款可重复外用的基因疗法获得FDA批准上市的利好刺激下,Krystal Biotech股价今年已经大涨60%,目前市值突破30亿美元(约218亿人民币)。
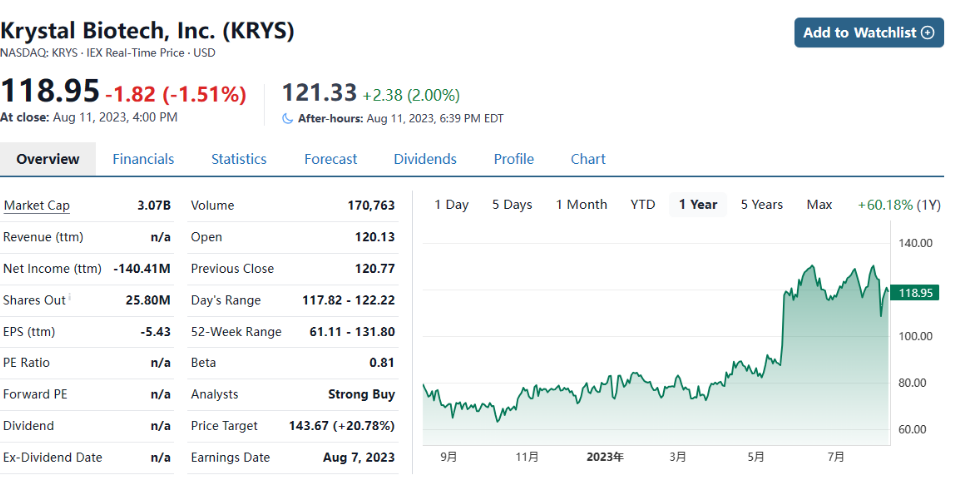
5月19日,美国FDA批准了Krystal Biotech公司开发的基因疗法VYJUVEK™(beremagene geperpavec-svdt,B-VEC)凝胶用于治疗6月龄及以上营养不良型大疱性表皮松解症(DEB)患者。这是FDA批准的首款可重复用药的基因疗法和首款外用基因疗法药物,同时也是首个FDA批准同时用于显性和隐性营养不良性大疱性表皮松解症(DEB)治疗的基因疗法药物。
VYJUVEK™基本信息
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库 VYJUVEK™ 的花费为 24,250 美元/瓶,平均每位患者每年使用 26 瓶。这意味着每位患者每年的费用约为63万美元,经过政府强制折扣后为48.5万美元。
VYJUVEK™采用1型单纯疱疹病毒(HSV-1)作为其重复递送的载体。其治疗原理是将COL7A1基因的正常拷贝输送至DEB患者的分裂和非分裂皮肤细胞,纠正遗传缺陷,使其皮肤细胞能够产生COL7蛋白,稳定患者脆弱的皮肤。
5月22日,Krystal完成1.6亿美元的私募股权融资。该笔资金将用于VYJUVEK™的启动、商业化运营及其他管线药物开发,预计可支持至2026年底。此轮融资由Avoro Capital Advisors和Redmile Group领投,Braidwell LP和Frazier Life Sciences参与其中。VYJUVEK™预计今年第三季度在美国上市。公司预计将于2023年下半年在欧洲启动正式的上市许可申请程序,并可能在2024年获得批准。
VYJUVEK™获批同时,Krystal获得了罕见儿科疾病优先审查凭证(PRV),可用于为另一产品申请优先审查。这为Krystal加速其他管线获批创造了新的机会。
关于Krystal Biotech
Krystal Biotech(纳斯达克股票代码:KRYS)是一家商业阶段的生物技术公司,专注于基因药物的发现、开发和商业化,以治疗医疗需求未得到满足的疾病。VYJUVEK TM是该公司的第一个商业产品,第一个可重复基因疗法,也是FDA批准的唯一用于治疗营养不良性大疱性表皮松解症的药物。该公司正在快速推进呼吸系统、肿瘤学、皮肤病学、眼科和美容领域的研究性基因药物的强大临床前和临床产品线。
Krystal Biotech研发管线
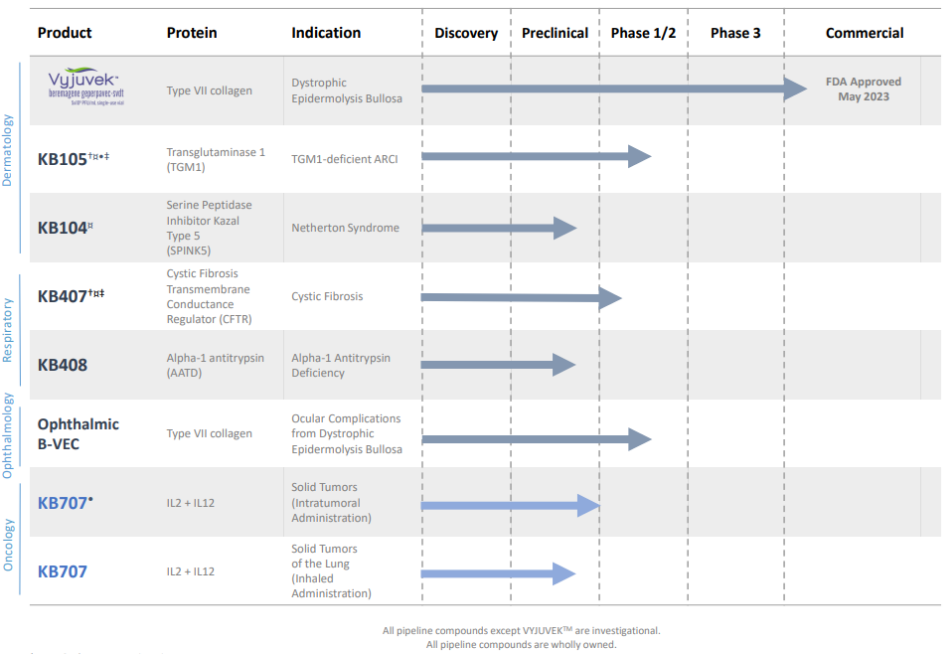
图片来源:公司官网
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论