
7月31日,中国国家药监局药品审评中心(CDE)官网公示,加科思申报的1类新药JAB-21822(格来雷塞,glecirasib)又一适应症拟纳入突破性治疗品种,拟用于治疗既往经过吉西他滨联合白蛋白紫杉醇或FOLFIRINOX方案治疗后出现疾病进展的KRAS G12C突变的局部晚期或转移性成人胰腺癌患者。
JAB-21822研发时间轴
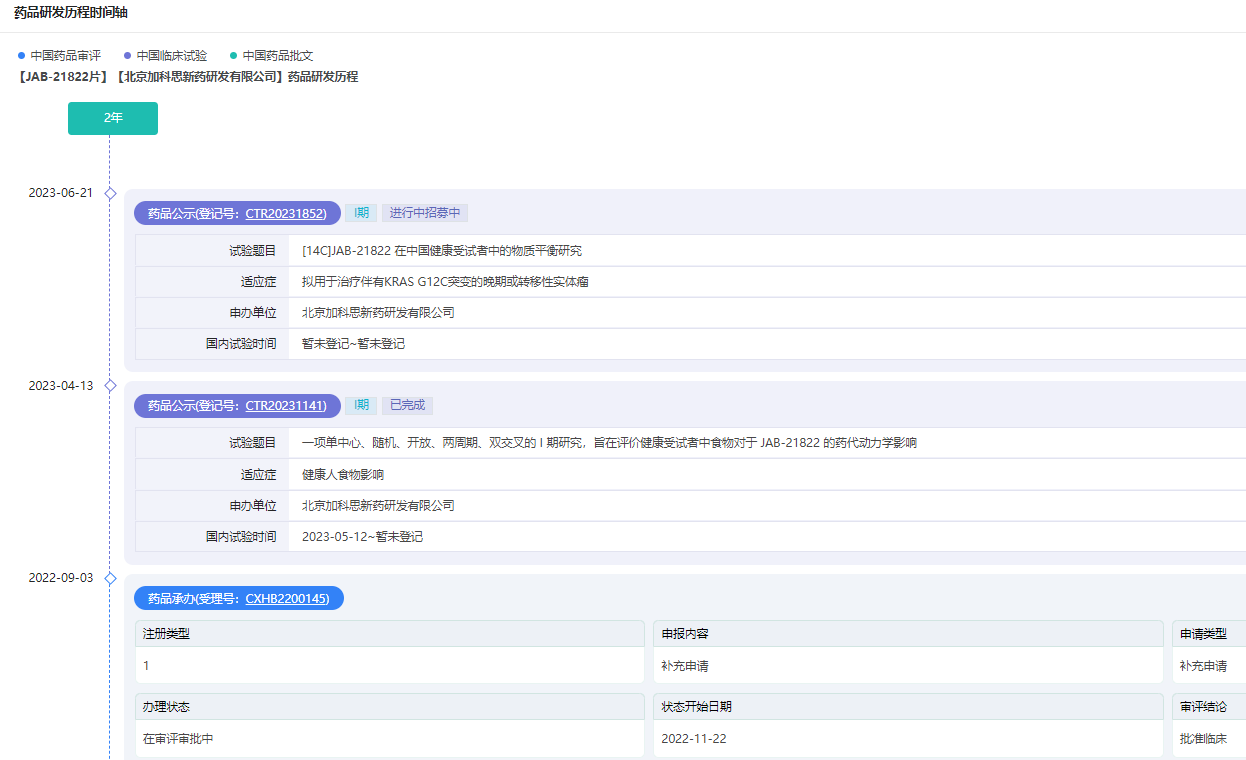
截图来源:药融云中国药品审批数据库
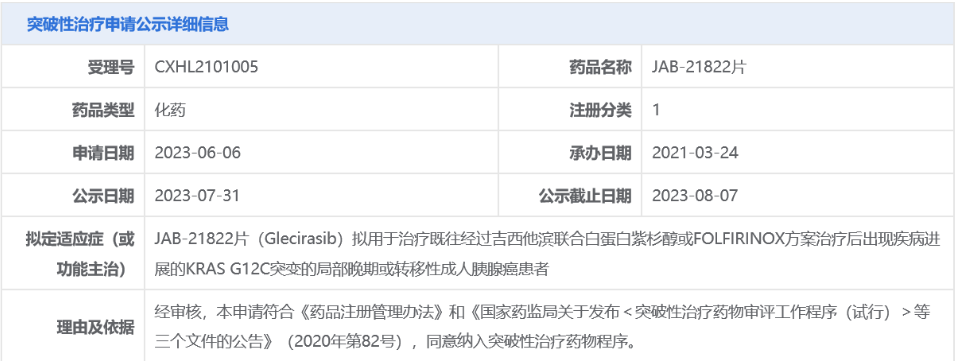
截图来源:CDE官网
作为一种KRAS p. G12C共价抑制剂,JAB-21822可以将KRAS p. G12C锁定在非活化状态,阻断KRAS向下游的信号转导,从而发挥抗肿瘤作用。目前,JAB-21822的临床开发进度为II期阶段,正在开展二线治疗携带KRAS G12C突变和STK11突变的非小细胞肺癌(NSCLC)的IIa期临床试验。加科思预计,这项IIa期研究若能成功完成,将提交JAB-21822的上市申请。
今年7月4日,JAB-21822获CDE批准开展注册性III期临床试验,用于单药二线治疗携带KRAS G12C突变的胰腺癌患者。该研究尚未启动。
目前,加科思已在中国、美国及欧洲多个国家和地区启动多项JAB-21822针对晚期实体瘤患者的1/2期临床试验,包括在中国非小细胞肺癌患者中开展的关键性临床试验,作为一线疗法单药治疗STK11共突变非小细胞肺癌,以及与SHP2抑制剂JAB-3312、抗PD-1单克隆抗体及EGFR靶向疗法西妥昔单抗联合用药。
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论