
2022年12月12日,美国食品和药物管理局(FDA)加速批准了Mirati Therapeutics的一款KRAS G12C抑制剂——adagrasib(Krazati,Mirati Therapeutics,Inc.),该药是一种KRAS GTPase家族抑制剂,用于经FDA批准检测确认的KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC),并且之前至少接受过一次全身治疗的成年患者。据悉,这是全球第二款报上市的KRAS G12C抑制剂。

FDA还批准了QIAGEN公司therascreen KRAS RGQ PCR试剂盒(组织)和Agilent Resolution ctDx FIRST Assay(血浆)作为Krazati的辅助诊断。如果血浆样本中未检测到突变,则应对肿瘤组织进行检测。
批准基于KRYSTAL-1,这是一项多中心、单臂、开放标签临床试验(NCT03785249),其中包括具有KRAS G12C突变的局部晚期或转移性NSCLC患者。对112名在铂基化疗和免疫检查点抑制剂同时或连续给药期间或之后病情进展的患者的疗效进行了评估。患者每日两次口服adagrasib600 mg,直到疾病进展或不可接受的毒性。
主要疗效结果指标是根据RECIST 1.1,通过盲法独立中心评审进行评估确定的客观应答率(ORR),,以及应答持续时间(DOR)。ORR为43%(95%CI:34%,53%),DOR中位数为8.5个月(95%CI:6.2,13.8)。
最常见的不良反应(≥ 20%)为腹泻、恶心、疲劳、呕吐、肌肉骨骼疼痛、肝毒性、肾损害、呼吸困难、水肿、食欲下降、咳嗽、肺炎、头晕、便秘、腹痛和QTc间期延长。最常见的实验室异常(≥ 25%)是淋巴细胞减少、天冬氨酸转氨酶增加、钠减少、血红蛋白减少、肌酐增加、白蛋白减少、丙氨酸转氨酶增加、脂肪酶增加、血小板减少、镁减少和钾减少。
adagrasib片的推荐剂量为600mg,每日口服两次,直到疾病进展或不可接受的毒性。
根据总体应答率和应答持续时间,加速批准该适应症。该适应症的后续批准可能取决于验证性试验中对临床益处的验证和描述。
本次审查使用了申请人自愿提交的评估援助(Assessment Aid),以促进FDA的评估。据药融云数据库显示,该KRAS G12C抑制剂在2021年的6月被美国FDA先后授予了快速通道、突破性疗法和孤儿药资格。
截图来源:药融云全球药物研发数据库
此前,adagrasib(MRTX849)在国内已经报IND。经药融云数据库查询显示,从2021年11月开始,CDE就陆续承办了Mirati Therapeutics和再鼎医药共同递交的MRTX849片临床申请,现已共有5条批准临床(临床默示许可)。
MRTX849片审评情况
截图来源:药融云中国药品审评数据库
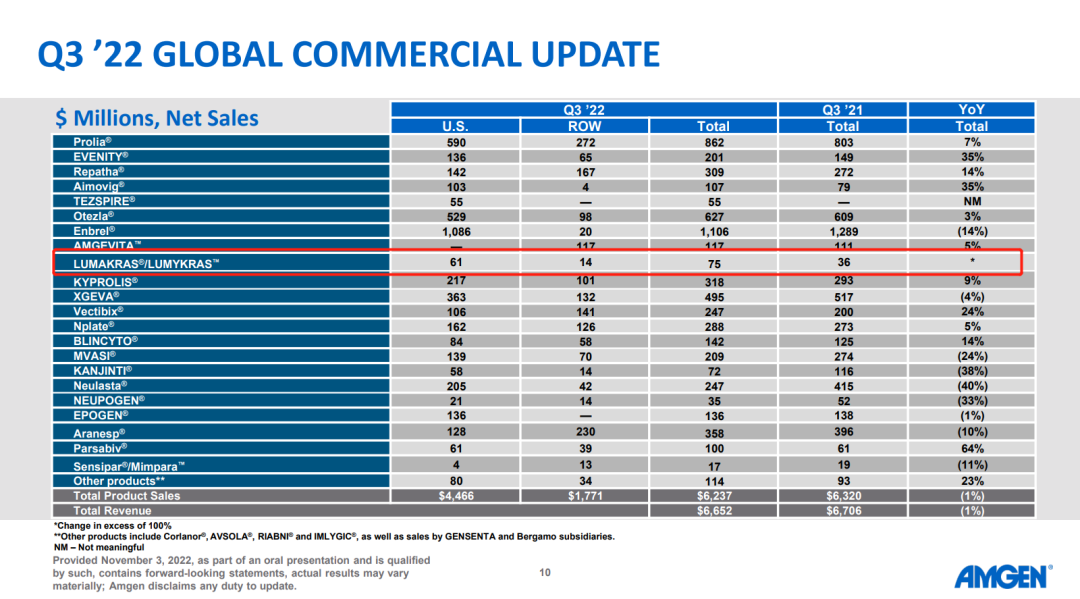
安进(AMGEN)此前拿下了全球首款上市的KRAS G12C抑制剂LUMAKRAS®/LUMYKRAS™(sotorasib),2022年Q3销售数据如下:
参考来源:
[1] FDA官网
[2] https://investors.amgen.com/static-files/22b5408c-0f1a-4073-a296-371b5d62da57
[3] 药融云数据库vip.pharnexcloud.com/?zmt-mhwz
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论