
引言

2月最后一天,美国食品和药物监督管理局(FDA)将迎来多款等待审批的NDA药物的PDUFA日期(基于The Prescription Drug User Fee Act法案规定的药品审批截止时间,FDA需要在此日期前对申请药物给出审评意见):
据Endpoints News报道,FDA正式批准传奇生物与强生的 BCMA CAR-T细胞疗法药物——Ciltacabtagene Autoleucel。“我们准备好了,”传奇首席执行官周一告诉 Endpoints News。“实际上,我们已经聘请了一支实干团队,包括销售人员、护士教育者、MSL、医学联络员。因此,我们确实有一支准备就绪的销售和营销团队。”
传奇生物和强生的CAR-T细胞疗法药物
Ciltacabtagene Autoleucel是一款靶向BCMA的CAR-T细胞疗法药物,用于治疗成人复发和/或难治性多发性骨髓瘤。该产品由强生旗下杨森(Janssen Biotech)与传奇生物(Legend Biotech)合作开发。最初的PDUFA日期是2021年10月28日,但FDA要求更新Janssen提供的分析方法数据,因此PDUFA日期被延迟至今年2月28日。
Ciltacabtagene Autoleucel基本信息

截图来源:药融云全球药物研发数据库
CAR-T细胞疗法
经药融云数据库查询,目前,全世界范围内在研的CAR-T细胞疗法药物超800款,其中,加上此次获批的传奇生物,共有8款获批上市,其他7款分别是诺华的Kymriah(tisagenlecleucel);Gilead/Kite的Yescarta(axicabtagene ciloleucel);吉利德的Tecartus(brexucabtagene autoleucel);BMS的Breyanzi(lisocabtagene maraleucel);BMS和蓝鸟生物的abecma(idecabtagene vicleucel);复星凯特的阿基仑赛注射液;药明巨诺的瑞基仑赛注射液。而此次传奇生物的Ciltacabtagene Autoleuce获得FDA批准,意味着正式成为中国首个进入美国市场的细胞疗法药物。其他7款的价格也已经出炉:《CAR-T全球上市7款价格/营收:诺华最贵47万美元一针》
CAR-T细胞疗法药物研发阶段
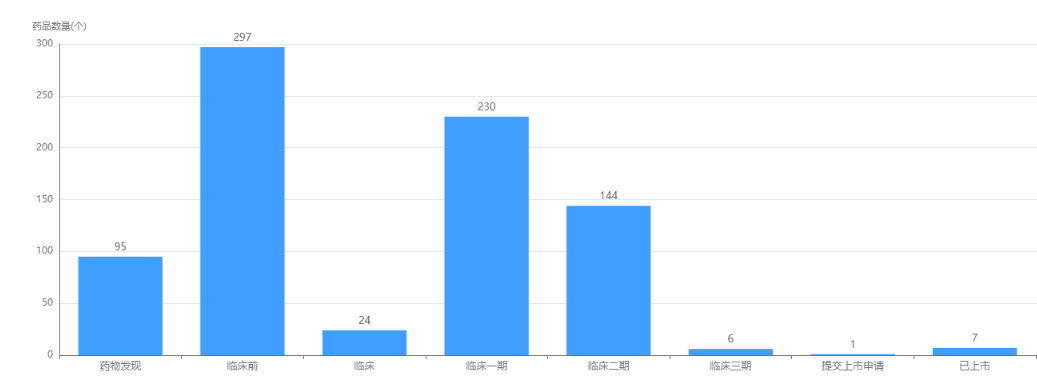
截图来源:药融云全球药物研发数据库
BCMA靶点
经药融云数据库查询,在所有CAR-T细胞疗法研发药物靶点中,BCMA排第二。目前,全世界范围内在研的BCMA靶点药物共有120款,其他还有212款研究终止或无后续报道,可见研发难度之大。其中,加上此次的传奇生物,共有3款获批上市,分别是葛兰素史克的 belantamab mafodotin 、百时美施贵宝的 idecabtagene vicleucel ;1款提交上市申请,强生的 teclistamab ;近60款正在进行临床试验。在所有药物里,针对多发性骨髓瘤的适应症占七成。
BCMA靶点药物研发阶段

截图来源:药融云全球药物研发数据库
关于传奇生物
传奇生物是一家肿瘤细胞免疫疗法研发商,研发了CD38和BCMA靶点治疗多发性骨髓瘤的CAR-T细胞疗法,利用自身免疫细胞,经体外基因改造后重新注射回病人体内,并利用这种强化过的免疫细胞精准靶向,杀死肿瘤细胞,主要用于治疗血癌和淋巴癌。
传奇生物一直专注于在肿瘤疾病领域进行药物研发,经查询,传奇生物产品管线在研的7款药物都是针对肿瘤领域,现有5款正在进行临床一期试验。
传奇生物产品管线
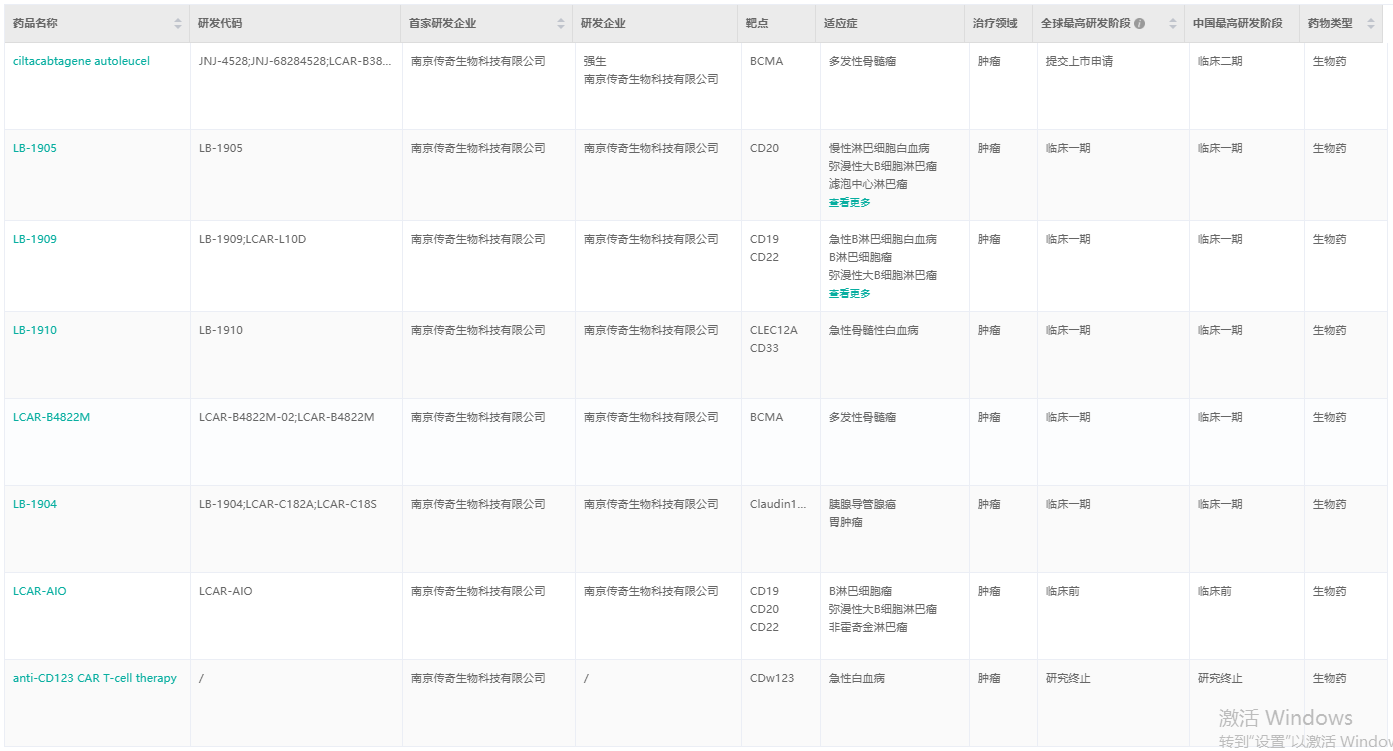
截图来源:药融云全球药物研发数据库
参考来源:
[1] FDA官网
[2] 各公司历史讯息
[3] 药融云数据库
想要解锁更多药物最新信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药物竞争格局、申报情况、最新进展、涉及靶点、市场规模与前景、可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论