【普利第一张国内造影剂创新药临床批件】 普利制药创新药注射用PL002获得中国药物临床试验批准
海南普利制药股份有限公司全资子公司浙江普利药业有限公司于近日收到了国家药品监督管理局(NMPA) 签发的创新药注射用PL002的药物临床试验批准通知书。
双模态造影剂PL002
脑胶质瘤是脑部最常见的原发性肿瘤,占中枢神经系统恶性肿瘤的81%。目前,脑胶质瘤的治疗仍以手术为主导。然而,手术在完全切除肿瘤方面常面临挑战,有时甚至难以实现。近年随着荧光成像技术在恶性脑胶质瘤精准手术中的广泛使用,使得瘤切除术肿瘤切缘可视化成为可能。但目前临床常用的荧光造影剂存在给药到手术时间不确定的问题,可能造成病灶与正常组织对比度不足,影响术中的病灶的判断。
PL002是浙江普利药业有限公司研发的荧光/磁共振双模态造影剂,荧光/磁共振双模态造影剂的成功研发将成为提高脑胶质瘤手术效率的有效方案。术中荧光技术与核磁共振成像的结合,相较于单独使用,能够更准确地识别肿瘤组织与功能区的位置关系,以及患者的肿瘤浸润边缘。这种联合使用不仅能在保留患者功能的前提下实现功能区脑胶质瘤的最大限度安全切除,还能有效降低术中神经损伤的风险。
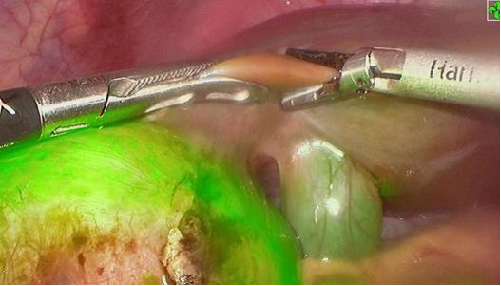
去年10月,PL002已经获得FDA签发的美国药物临床试验批件,用于原发性肝癌患者的术前诊断及术中导航。此次在国内申报的适应症为脑胶质瘤患者的术前诊断及术中导航。相较于原发性肝癌,脑胶质瘤对于切除精度要求更高,尤其是临近重要功能区的时候,因此对精准诊断的造影剂的临床需求更为迫切。
普利制药
作为中国“造影剂创新药的引领者”,普利制药一直致力于造影剂创新药的研发。注射用PL002的成功研发将丰富公司造影剂领域产品,并对公司拓展造影剂市场带来积极影响。此次创新药注射用PL002在中国和美国的药物临床试验的双获批,走出了公司造影剂创新药全球化布局的重要一步。同时,公司注射用PL002其他市场的新药临床试验申请工作也在持续推进中。
这次创新药注射用PL002获得中国药物临床试验批准,是对公司研发实力及产品质量的高度认可,标志着普利制药在造影剂创新药的研发及全球市场拓展上取得了重要突破。在未来的发展中,普利制药将继续为全球患者提供更多、更好的创新药物,为人类的健康事业做出更大的贡献。

欢迎国内外朋友合作推进创新药的临床研究及商业化,共赢发展。
业务联系人:周先生
邮箱:zhoujun@hnpoly.com





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论