
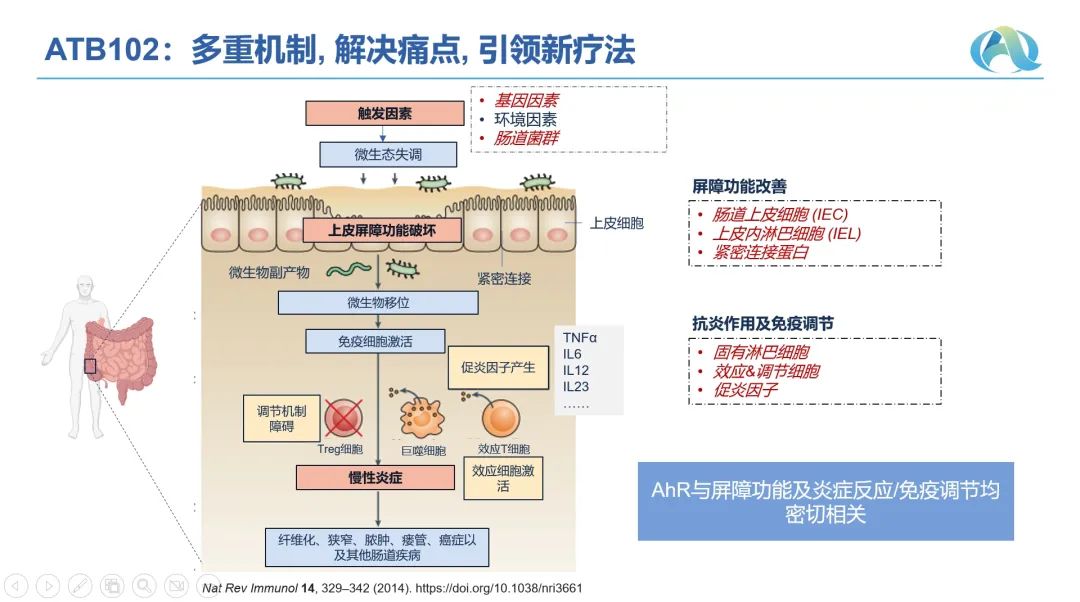
近日,BioBAY园内企业元启生物宣布,其自主研发的首个肠道富集小分子口服新药ATB102获得美国食品药品监督管理局(FDA)临床许可,标志着ATB102即将在美国启动临床试验,为全球IBD患者带来新的治疗希望。“ATB102是元启生物制药自主研发的肠道富集芳香烃受体(AhR)调节剂,是一个多重作用机制的IBD创新疗法。有别于已获批或其他在研的炎症性肠病生物药和小分子药,ATB102不但能促进和维持免疫稳态,还能增强肠道粘膜屏障的修复功能,并具有抗纤维化和抗氧化等作用。元启自创立以来,秉承临床导向自主创新的精神,努力以全球市场为目的推动高质量的管线项目。此次ATB102 FDA获批,是团队不懈坚持的结果,也是公司成长为临床阶段生物科技公司的里程碑!”元启生物制药创始人兼首席执行官丁元华博士介绍道,“ATB102多重作用机制已在临床前研究中得到证实,并在多个IBD动物模型中证实其与已获批口服标准治疗相比疗效更佳。元启将与临床专家共同积极推进ATB102的临床试验,争取早日惠及全球IBD患者。”IBD被称为“绿色癌症”,是一组病因及发病机制尚未完全阐明、反复发作的肠道慢性炎症性疾病,主要包括溃疡性结肠炎及克罗恩病。全球IBD患者约千万,随着经济社会发展及生活方式改变,中国IBD发病率快速上升。炎症性肠病好发于青壮年,难以治愈,致残率高,严重影响患者生存质量,给患者及其家庭带来沉重的负担。由于其病因及发病机制尚未完全阐明,由多因素相互作用所致,包括环境、遗传、感染和免疫因素。目前以炎症或免疫抑制为主的治疗药物临床缓解率仅为20%~40%,临床医生和患者尤其期待疗效带来突破且安全的口服新药。▌文章来源:元启生物
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。






收藏
登录后参与评论