


德曲妥珠单抗是一种创新的抗体偶联药物(ADC),其设计目的是将拓扑异构酶1抑制剂直接输送到表达HER2的癌细胞中。这种药物的作用机制包括以下几个步骤:首先,药物的抗体部分能够特异性地识别并结合到癌细胞表面的HER2受体;接着,这种结合促使德曲妥珠单抗被癌细胞内吞;随后,在细胞内释放其携带的化疗药物;最终,这些释放的化疗药物不仅能够杀死目标癌细胞,还可能对周围的癌细胞产生杀伤作用。
德曲妥珠单抗的这一作用机制,使得其能够更精准地打击癌细胞,减少对正常细胞的损伤。此外,由于其携带的化疗药物是拓扑异构酶1抑制剂,这种药物具有更强的细胞毒性,能够更有效地杀死癌细胞。因此,德曲妥珠单抗在治疗HER2阳性或HER2突变的癌症患者中,展现出了显著的临床疗效。
此次附条件批准是基于DESTINY-Lung02和DESTINY-Lung05 II期临床试验的积极结果。该适应症的完全批准将取决于开展的确证性试验的临床获益。
DESTINY-Lung02
研究设计
DESTINY-Lung02研究是一项双盲、随机、II期临床研究,进一步评估德曲妥珠单抗 5.4 mg/kg和 6.4 mg/kg不同剂量的治疗获益及风险,旨在探索德曲妥珠单抗的最佳药物剂量。该研究共纳入 152 例既往接受过一种系统性治疗的不可切除或转移性HER2突变NSCLC患者,以 2:1 的比例随机分配接受 5.4 mg/kg和 6.4 mg/kg剂量的德曲妥珠单抗治疗。主要研究终点是通过盲态独立中心审查(BICR)的cORR,次要研究终点包括研究者评估的cORR、缓解持续时间(DoR)、疾病控制率(DCR)、PFS、OS以及安全性。

研究结果
在 2023 年WCLC大会上,公布了DESTINY-Lung02研究的主要研究结果。截至 2022 年 12 月 23 日,研究共纳入 152 例患者,其中 5.4 mg/kg组纳入 102 例患者,6.4 mg/kg组纳入了 50 例患者。5.4 mg/kg组的中位随访时间为 11.5 个月(1.1-20.6 个月),6.4 mg/kg组为 11.8 个月(0.6-21.0个月)。两组BICR的cORR分别为 49.0%(95%CI:39.0%-59.1%)和56.0%(95%CI:41.3%-70.0%),BICR的中位DoR分别为 16.8 个月(95%CI:6.4个月-NE)和NE(95%CI:8.3个月-NE),BICR的中位PFS分别为 9.9 个月(95%CI:7.4个月-NE)和 15.4 个月(95%CI:8.3个月-NE)。中位总生存期(OS)分别为 19.5 个月(95% CI: 13.6, NE)和NE。
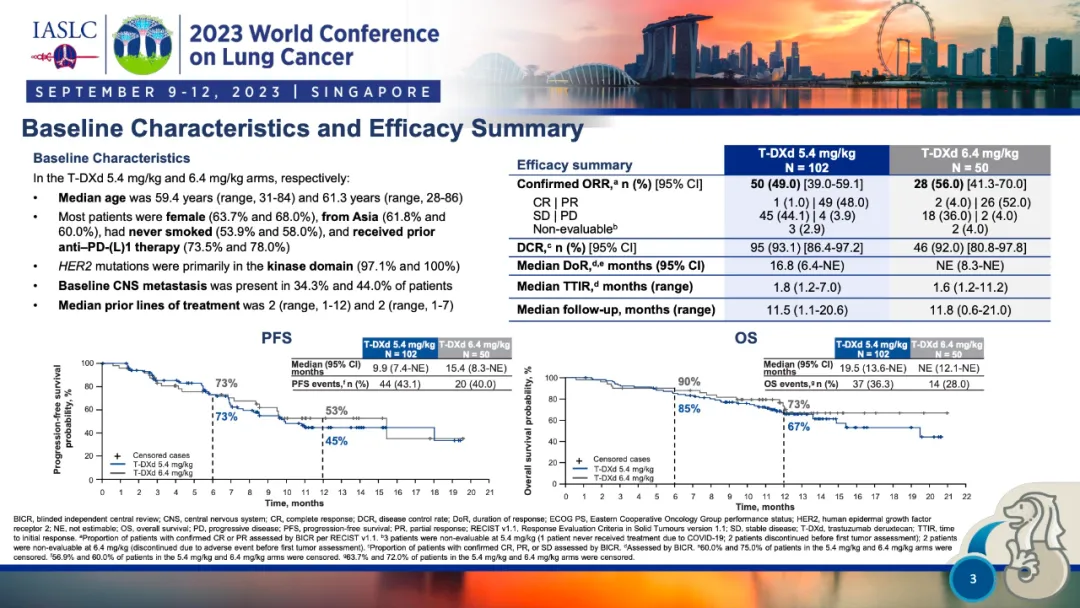
▲基线数据和疗效总结
在 2024 年ASCO大会上公布了DESTINY-Lung02研究的最终结果,分别有 102 例和 50 例患者接受 5.4mg/kg 及 6.4mg/kg 德曲妥珠单抗治疗。两组中亚洲患者占比分别高达 61.8% 和 60.0%,大多数患者既往曾接受过PD-(L)1抑制剂治疗(73.5% 和 78.0%),分别有 34.3% 和 44.0% 的患者基线时存在脑转移。

截至数据截止日期(2023 年 8 月 25 日)时,德曲妥珠单抗 5.4 mg/kg、6.4 mg/kg 组的中位随访时间分别为 15.8 个月和 16.5 个月。两组的cORR分别为 50.0%(95%CI,39.9-60.1)、56.0%(95%CI,41.3-70.0)。且与主要分析结果一致,对于高比例的基线脑转移及亚洲患者人群,德曲妥珠单抗均带来了明确的肿瘤缓解获益。
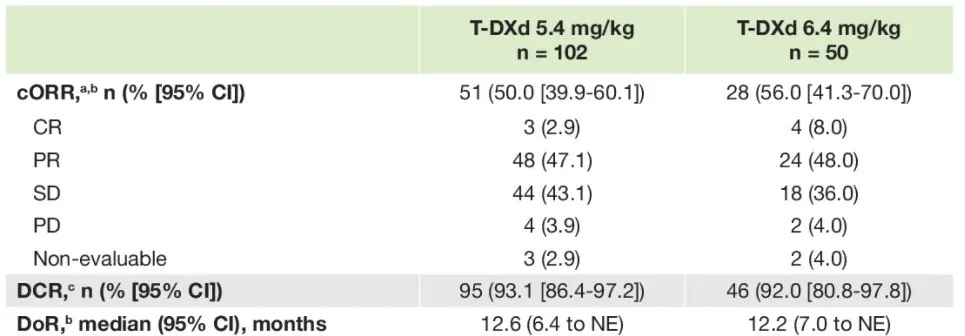
2024 年ASCO大会更新数据显示,5.4 mg/kg、6.4 mg/kg 组的中位PFS分别为 10.0 个月(95%CI 7.7-15.2)和 12.9 个月(95%CI 7.2-16.7),中位OS分别为 19.0 个月(95%CI 14.7-NE)和 17.3 个月(95%CI 13.8-NE),为患者带来了明确的长期获益。

研究结论
公布的最终结果表明,随着随访时间的进一步延长,德曲妥珠单抗在HER2突变NSCLC后线治疗中仍持续展现出显著而持久的疗效,同时安全性良好,治疗不影响患者的总体生活质量。在剂量选择方面,目前获批的德曲妥珠单抗 5.4 mg/kg 剂量具有更有利的效益 - 风险特征,并且与药物相关的ILD/肺炎发生率更低。
DESTINY-Lung05
研究设计
DESTINY-Lung05研究是一项开放性、单臂、II期研究(NCT05246514),也是DESTINY-Lung02研究的中国桥接研究,旨在评估德曲妥珠单抗在携带HER2 19/20 号外显子突变的转移性非鳞状NSCLC中国患者的疗效和安全性。患者接受德曲妥珠单抗使用剂量为 5.4 mg/kg Q3W,主要研究终点是由独立中心审查(ICR)评估的客观缓解率(ORR),次要终点包括研究者评估的ORR,以及研究者和ICR评估的疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)和安全性等。

▲研究设计
研究结果
截止 2023 年 9 月 23 日,共有 72 位患者接受了德曲妥珠单抗(5.4mg/kg Q3W)治疗,中位随访时间为 9.8 个月。

▲基线数据
疗效数据方面显示,在 72 位患者中,根据ICR和研究者的评估确认的ORR为 58.3%,其中 1 位患达到了完全缓解,41 位患者达到了部分缓解。DCR分别为 91.7%(ICR评估)和 93.1%(研究者评估)。

▲经ICR评估的最佳缓解
目前ICR和研究者评估的中位PFS分别为NE(95%CI:7.2个月-NE)、10.8 个月(95% CI:7.2个月-NE)。DESTINY-Lung05的疗效数据再次证明了德曲妥珠单抗在HER2突变经治的晚期或转移性NSCLC患者中持久有效的抗肿瘤活性,更为中国患者的临床新选择带来了有力的支持证据。
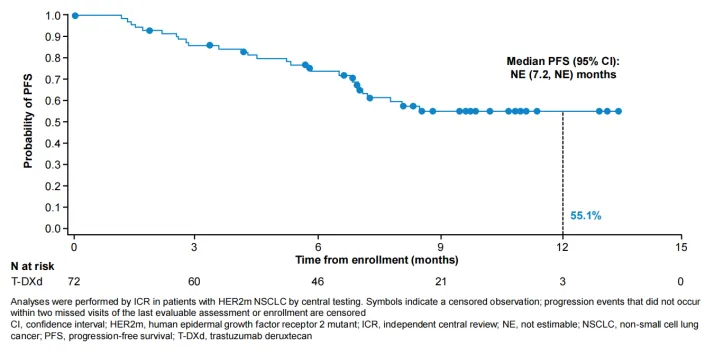
▲经ICR评估的PFS曲线
安全性方面,中国患者中的安全性事件与德曲妥珠单抗既往的临床试验一致。共有 51.4%的患者发生了≥3级的药物相关不良事件,其中最常见的为:中性粒细胞减少(26.4%)、血小板减少(18.1%)、白细胞减少(11.1%)和淋巴细胞减少(6.9%),药物相关的肺间质性疾病/肺炎发生率仅为 9.7%,且多为低级别,药物相关不良反应引起的患者停药比例仅为 2.8%。

▲安全性数据
研究结论




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论