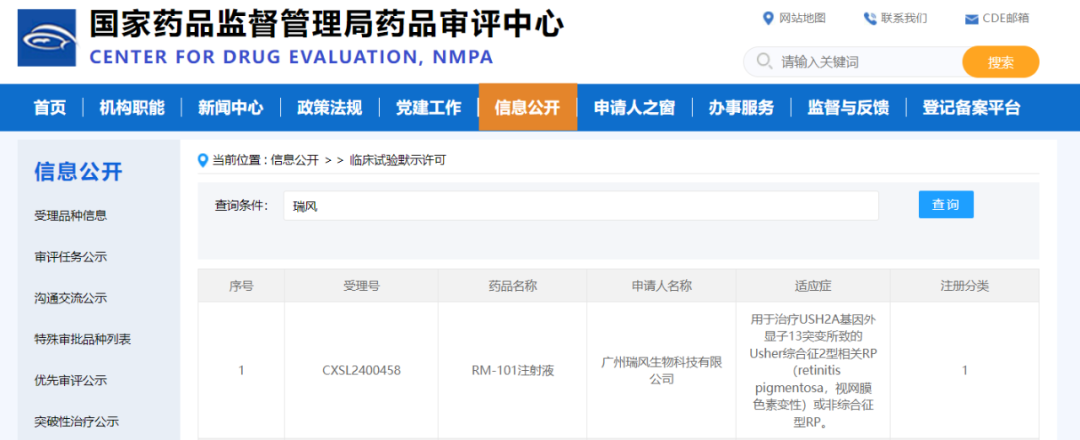
瑞风生物自主研发的Usher综合征基因编辑药物RM-101新药临床试验申请,于2024年10月11日获得国家药品监督管理局药品审评中心(CDE)的默示许可。这标志着瑞风生物全球首款Usher综合征基因编辑药物在中国即将进入临床阶段,为中国患者带来新的希望。值得一提的是,RM-101已在美国时间9月17日获得美国食品药品监督管理局(FDA)的IND批准。至此,瑞风生物实现了Usher综合征创新基因编辑药物的中美两地IND的双报双批。视网膜色素变性(Retinitis pigmentosa)是一组严重的遗传性眼科疾病,主要特征为视网膜光感受器细胞的进行性退化,导致视力逐渐丧失。Usher综合征是与视网膜色素变性有关的最常见综合征。Usher综合征主要分为三种类型,其中II型最为普遍,约占所有Usher病例的70%,其最常见致病基因为USH2A。Usher综合征患者经历渐进式的视觉功能丧失,初期表现为夜间视力下降,逐渐发展为视野狭窄、中心视力下降乃至失明,一般伴随非退行性听力异常。目前,Usher综合征暂无获批的药物或治疗方法,存在着巨大的未被满足的临床需求,基因编辑治疗有望扭转这一局面。瑞风生物自主研发的基因编辑药物RM-101,有望通过一次性视网膜下注射,在患者的视网膜感光细胞中诱导产生功能性的蛋白,最终提升患者视力。RM-101是瑞风生物开发的针对Usher综合征USH2A基因相关视网膜色素变性的创新药物产品。RM-101是基于AAV的基因编辑类药物,能特异靶向USH2A RNA,调控可变剪接生物学过程,诱导功能正常蛋白的表达恢复。RM-101通过视网膜下注射给药,有望实现一次性给药并长期有效。瑞风生物是中国头部的基因编辑药物创新企业,以基因编辑技术为核心驱动,致力于革新性药物的诞生。瑞风生物是国际上早期应用基因编辑探索遗传疾病治疗的高水平团队,并持续在血液科、眼科等疾病方向积累了开创性成果,在包括基因编辑工具创新、成药策略发现、新型动物模型构建、多层次药效和安全性评估等层面具备了高水平的技术积累,拥有体内和体外两大创新药物方向。瑞风生物的使命是基于革新性的基因技术,为严重疾病患者提供可及性和治愈性药物。目前在遗传病、复杂疾病和肿瘤领域等皆有管线布局,其中β-地贫创新药已经取得全球先进水平的临床进展,α-地贫方面实现了全球首例患者治愈的突破,Usher综合征全球首创基因编辑药物IND申请已获中美监管部门批准。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论