

自主知识产权、精准性高、国内外首创
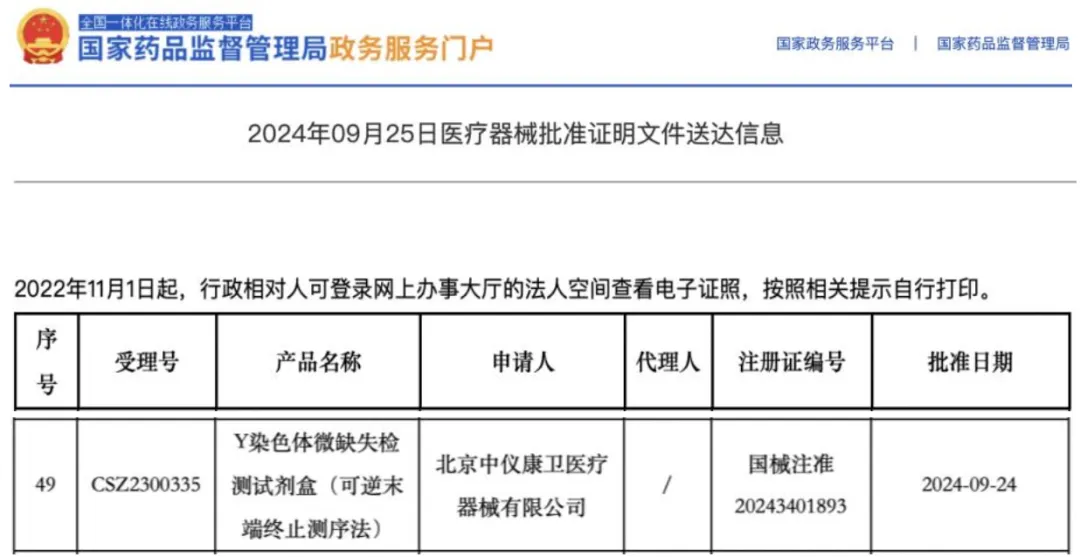
这是全国首个基于可逆末端终止测序法的Y染色体微缺失检测试剂盒(下文简称“NGS-AZF”),与已批准上市的基于PCR法的AZF检测试剂盒的检测方法和技术原理均不同,具有完全自主知识产权(国家知识产权局发明专利专利号:ZL 201510679999.1和ZL 202110945887.1,软件著作权证书号:软著登字第2249513号和软著登字第4582464号),基于NGS检测平台,精准性高、国内外首创。高通量测序技术全国首证,助力开启Y染色体AZF检测新篇章。
检测一致性100%
临床试验入组超过1000例样本,与已上市同类产品(PCR法)比较,检测阳性符合率为100%(95%CI:97.31%,100%),阴性符合率为100%(95%CI:99.56%,100%),总符合率为100%(95%CI:99.62%,100%)(来源:注册数据)。
国内外首创
NGS-AZF检测试剂盒分别于2019年、2024年进行国内外科技查新,报告结果显示:国内外未见完全相同报道(来源:科技查新报告),确定为国内外的首个创新技术。



2020年,中华医学会男科分会发布的《男性生殖相关基因检测专家共识》[2]中提到:“Y染色体AZF区域缺失推荐检测位点主要根据欧美人群建立,是否完全适用于中国人群尚无定论。鼓励有条件的医疗机构通过高通量检测技术(如NGS)进行深入研究”。此前,2004年欧洲男科学会/欧洲分子遗传质量网络(EAA/EMQN)指南[3]推荐针对Y染色体AZF检测6个位点,2013年EAA/EMQN指南[4]指出为降低诊断的错误率,在6个位点基础上需要进行拓展位点的分析。2023年,时隔十年,EAA/EMQN更新发布《2023新版EAA/EMQN Y染色体微缺失分子诊断最佳实践指南》[5],针对NGS技术的应用提到:虽然两步多重PCR法(基础多重PCR检测位点体系+增加扩展性位点的AZF缺失分析)仍然是目前AZF缺失检测的金标准,但若实验室考虑建立替代方法(如使用基于NGS的方法),谨慎对待是必须的,需要在适当数量的样本上验证新方法,包括阳性和阴性对照,以评估检测的特异性和敏感性,必须要有适当验证和Y染色体分析的广泛专业知识。随着这项技术的可用性和正确实施变得越来越普遍,它可能会带来新的、更全面的检测,从而进一步提高无精子症男性的诊断率。强烈鼓励AZF检测实验室每年参与外部质量控制计划。自2019年来,嘉宝仁和NGS-AZF检测项目在加强内部质控管理的同时,定期参加国内外室间质评和能力验证,对检测的准确性进行质量评估,确保检测性能;连续6年以优异的成绩通过欧洲分子基因诊断质量联盟EMQN室间评价,满分通过江苏省妇幼健康研究会生殖检验质控中心室间质评(2024年第一次),也是嘉宝医学实验室CAP认证项目之一,连续三次复审合格。这意味着嘉宝仁和NGS-AZF检测体系和质量获得了国内外的多重认可,检测能力经过相关法规、质控规范系统多方严格评审。

参考文献
上下滑动查看

关于EMQN
欧洲分子基因诊断质量联盟(European Molecular Genetics Quality Network, EMQN)是国际权威室间质评检测机构,作为全球分子遗传学检测质量保证和标准化先锋,在全球享有极高的行业地位,其提供的室间质评服务以严苛、全面著称。EMQN考核结果反映实验室技术的准确性、质量管理的规范性以及检测服务的专业性,是全球分子遗传学临床实验室最高水平的认证标准之一。

关于CAP
美国病理学家协会(College of American Pathologists, CAP),国际公认的实验室质量保障领导者、权威实验管理和认证组织。CAP认证是美国病理学家协会组织的临床实验质量认证计划,在全球被公认为是行业的“金标准”。CAP为美国非盈利性的临床实验室认可机构,依据美国临床检验标准化委员会(CLSI)的业务标准和操作指南,以及美国临床实验室改进规范(CLIA’88),对临床实验室各个学科的所有方面均制定了详细的Checklist,通过严格要求来确保实验室符合质量标准,从而改进实验室的实际工作。CAP致力于临床实验室步骤的标准化和改进,倡导高质量和经济有效的医疗保健服务,其所产生的影响超过了其他任何一个组织。CAP认证自1962年起在美国普遍采用执行,1994年起被世界各国公认为最适合医疗检验实验室的国际级实验室标准。CAP认证是对实验室技术管理水平的全面认可,通过CAP认证的实验室代表其实验室质量与水准达到国际顶尖水准,并获得国际间各相关机构认同。

(来源:嘉宝仁和)






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论