
第27届全国临床肿瘤学大会暨2024年CSCO学术年会上,中国生物制药(1177.HK)以口头报告的形式公布了自主研发的1类新药“库莫西利胶囊”在针对内分泌经治的激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)晚期乳腺癌III期研究(TQB3616-III-01)的最新成果:中位无进展生存期(PFS)为16.62个月,客观缓解率(ORR)为40.21%,总生存期(OS)呈获益趋势。


乳腺癌是中国女性最常见的十大恶性肿瘤中发病率排在第二位的癌症,中国每年新发病例数达36万[1]。近年来,乳腺癌发病率和死亡率均呈上升趋势,其中约60%-70%的乳腺癌患者为HR阳性、HER2阴性。本次大会发布的TQB3616-III-01研究是全球首个口服CDK2/4/6抑制剂联合内分泌治疗用于HR阳性、HER2阴性晚期乳腺癌取得阳性结果的III期试验。
PFS具有统计学和临床上双重显著获益
TQB3616-III-01研究结果[2]显示,试验组库莫西利联合氟维司群的中位PFS为16.62个月,较对照组PFS延长9.16个月;库莫西利联合治疗将疾病进展/死亡风险降低64%(HR=0.36,P<0.0001)。该研究的主要研究结果中位PFS、HR和PFS绝对获益程度均高于对照组。
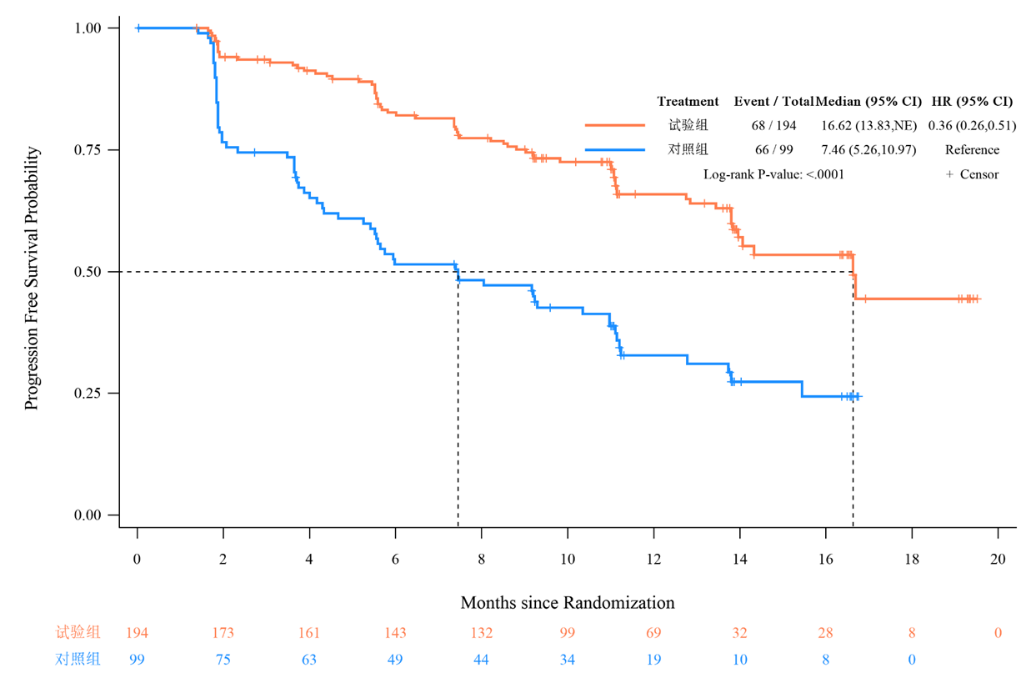
主要终点研究者评估的PFS生存曲线图
PFS亚组分析显示在所有预设的亚组因素,与对照组相比库莫西利联合治疗的HR估值均<1,获益趋势与主分析一致。其中,在接受过解救化疗、PR阴性、内分泌原发耐药、HER2低表达、内脏转移等亚组中,试验组PFS获益更明显。
呈现显著的肿瘤缓解和生存获益趋势
TQB3616-III-01研究结果[2]显示,库莫西利联合治疗与对照组相比,显著提高患者经确认的客观缓解率(ORR)(40.21% vs 12.12%);在有可测量病灶的患者人群中经确认的ORR提升更高(46.43% vs 14.12%),已显示出明显的OS获益趋势。安全性方面,库莫西利联合氟维司群最常见的治疗相关不良事件(TRAEs)多数为1-2级,易于管理,≥3级骨髓抑制等血液学毒性小。
有望克服临床CDK4/6抑制剂耐药问题
库莫西利作为一种新型周期蛋白依赖性激酶2、4和6(CDK2/4/6)抑制剂,对CDK2、CDK4、CDK6激酶有不同程度的抑制效果。研究结果显示,其增强的CDK2和CDK4抑制活性可能有助于在临床上克服目前CDK4/6抑制剂的耐药性问题[3]。
今年7月,国家药品监督管理局药品审评中心(CDE)已受理库莫西利联合氟维司群用于既往内分泌经治的HR阳性、HER2阴性局部晚期或转移性乳腺癌适应症的上市申请。此外,库莫西利用于HR+/HER2-乳腺癌一线治疗及辅助治疗的III期临床试验,预计将于未来两年逐步递交上市申请,有望为更多的HR+/HER2-乳腺癌患者提供治疗新选择。
本次CSCO年会,中国生物制药还公布了其他20多项最新研究成果,全面展示在多个肿瘤治疗领域取得的突破性进展。未来,公司将继续聚焦肿瘤领域创新,深入探索创新药物与治疗方案,以期为肿瘤患者带来更多获益,让健康科技,温暖更多生命。
资料来源:
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians 2024; 74(3): 229-63.
[2] 2024 CSCO, 9月27日创新专场.
[3] Xu Z, Liu Y, Song B, et al. Discovery and preclinical evaluations of TQB3616, a novel CDK4-biased inhibitor. Bioorganic & Medicinal Chemistry Letters 2024; 107.
声明:
1. 本新闻稿旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参阅,非广告用途。
2. 本公司不对任何药品和/或适应症作推荐。
3. 本新闻稿中涉及的信息仅供参考,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。若您想了解具体疾病诊疗信息,请遵从医生或其他医疗卫生专业人士的意见或指导。
前瞻性声明:
本新闻稿中包含若干前瞻性陈述,包括有关【库莫西利胶囊、氟维司群注射液】的临床开发计划、临床获益与优势的预期、商业化展望、患者临床获益可能性,以及潜在商业机会等声明。“预期”、“相信”、“继续”、“可能”、“估计”、“期望”、“有望”、“打算”、“计划”、“潜在”、“预测”、“预计”、“应该”、“将”、“拟”、“会”和类似表达旨在识别前瞻性陈述,但并非所有前瞻性陈述都包含这些识别词。这些前瞻性陈述为公司基于当前所掌握的数据和信息所做的预测或期望,可能因受到政策、研发、市场及监管等不确定因素或风险的影响,而导致实际结果与前瞻性陈述有重大差异。请现有或潜在的投资者审慎考虑可能存在的风险,并不可完全依赖本新闻稿中的前瞻性陈述,该等陈述包含信息仅及于本新闻稿发布当日。除非法律要求,本公司无义务因新信息、未来事件或其他情况而对本新闻稿中任何前瞻性陈述进行更新或修改。
内容来源:中国生物制药有限公司于香港联交所发布的公告、中国生物制药有限公司官网、正大天晴药业集团公众号

首款国产利斯的明透皮贴剂获批 中国生物制药关怀阿尔茨海默病患者
中国生物制药在2024 ESMO大放异彩,四项Mini oral展现难治性疾病治疗新希望
中位PFS显著延长至18.96个月,中国生物制药安罗替尼联合贝莫苏拜单抗一线治疗晚期肾癌最新研究数据公布
双终点阳性!中国生物制药安罗替尼联合派安普利单抗一线治疗晚期肝癌取得重要突破
首登顶级学术盛会+新剂型获批临床 中国生物制药呼吸领域1类新药PDE3/4抑制剂喜讯连连










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论