
近日,由锐正基因研制的ART001获得了美国FDA临床试验许可,成为我国第一个获美国FDA临床试验许可的基于非病毒载体的体内基因编辑药物。此次美国FDA IND获批,也让ART001成为全球同类药物中唯一获得中美两国临床试验许可的产品。一时间,基于非病毒载体的基因编辑药物递送也成为了热门话题。毫无疑问,精准的体内基因编辑分子递送将为生命科学领域带来新的变革。CRISPR-Cas系统因其高效性和多功能性,已经在基因组编辑中得到了广泛应用。通过脱靶预测和蛋白质工程,Cas9的特异性已有所提高,但向特定细胞或组织的靶向递送仍然是一个重大挑战。如果能够在遗传性疾病中仅针对受影响的细胞进行编辑将提高安全性并降低成本。图注:非病毒载体CRISPR-Cas基因编辑器的递送策略
而目前常用的逆转录病毒和腺相关病毒(AAVs)等病毒载体的递送方法,在具有大转基因容量和细胞特异性靶向等优势的同时,也存在风险,包括免疫原性、长期核酸酶表达导致的脱靶编辑以及潜在的基因组整合。
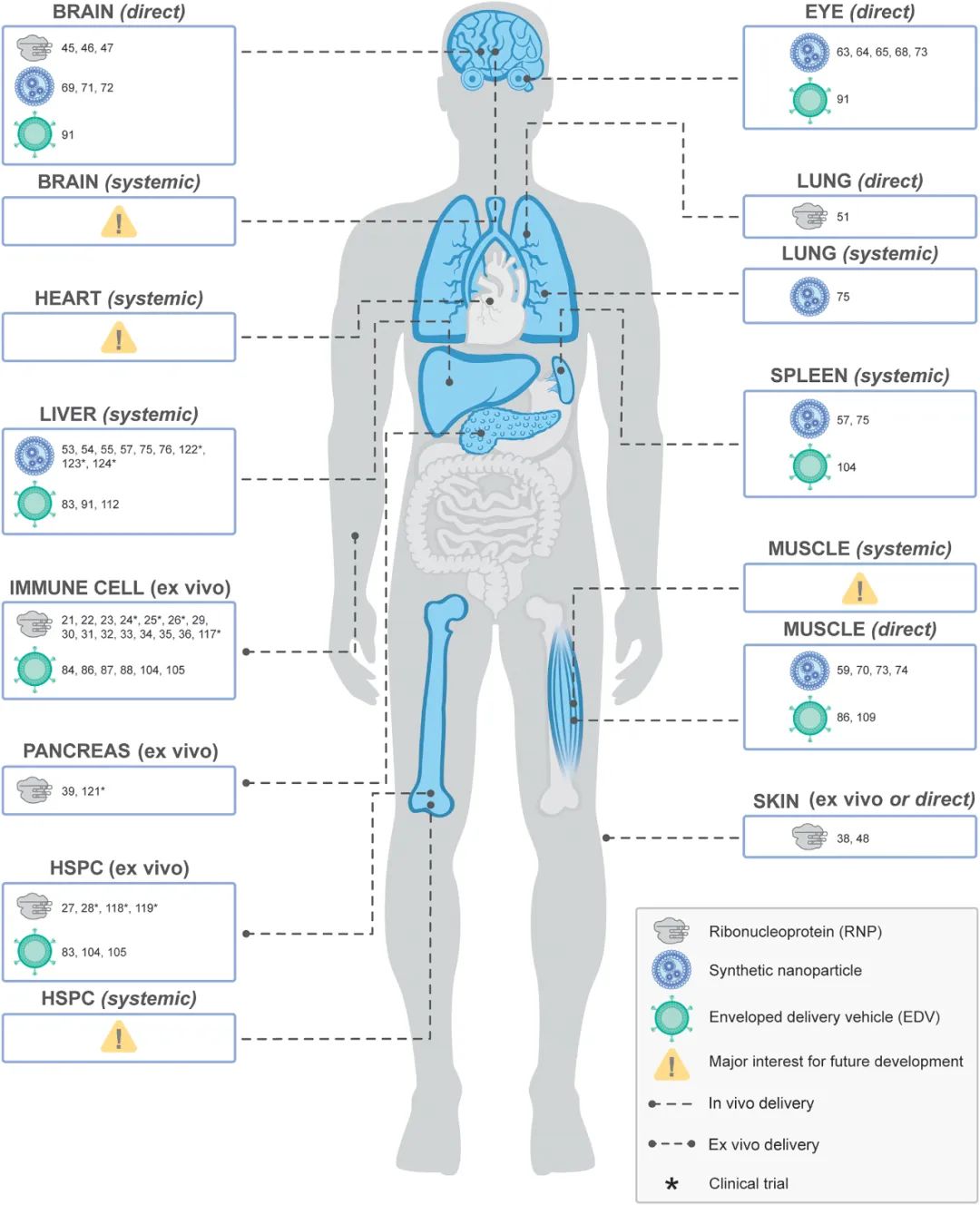
相比之下,合成纳米颗粒在基因组编辑递送方面具有明显的优势,它们不仅能够巧妙地规避人体内天然的异物清除机制,确保编辑工具的稳定存在,还实现了RNA或RNP的高效细胞质递送。在众多纳米颗粒中,先前提到的ART001所使用的LNPs凭借其独特的组成——磷脂、可电离阳离子脂质、PEG脂质以及胆固醇的巧妙结合,成为了业界的宠儿。这些纳米颗粒首先通过内吞作用进入细胞,随后,其内部的可电离脂质会巧妙地瓦解内体膜,促使所携带的货物(如RNA或RNP)安全释放至细胞质中,从而启动基因编辑过程。尤为值得一提的是,LNPs在包装长核酸序列方面的能力远超传统AAV载体,这一特性为基因组编辑的精准性和效率带来了革命性的提升。例如,封装了针对Cas9基腺嘌呤和胞嘧啶碱基编辑器的mRNA和sgRNA的LNPs,已在实验中被证实能够在小鼠和非人灵长类动物的肝脏中实现高水平的基因编辑,展现了其巨大的治疗潜力。此外,随着基因组编辑技术的不断发展,对更大、更复杂编辑工具的需求日益增长。LNPs凭借其卓越的包装能力,不仅能够递送比经典化脓性链球菌Cas9更大的货物,还能支持包括具有广泛功能的Cas9融合蛋白在内的多种编辑工具,为基因组编辑的广泛应用开辟了新的道路。当然,在使用LNPs进行基因编辑时,也需要精心设计和优化递送条件,以确保蛋白质组分的有效封装和结构完整性,从而最大化编辑效率和安全性。静脉注射LNPs通常会导致其在肝脏中的被动积聚,这主要是由于形成了富含载脂蛋白E(ApoE)的蛋白质冠。这种天然的肝脏靶向性已被用于肝细胞基因组编辑,目前正在进行的使用含有Cas9 mRNA和sgRNA的LNPs的临床试验即是一例。类似的被动靶向也发生在其他纳米颗粒上,如用Cas9核糖核蛋白(RNPs)修饰的金纳米颗粒,这些颗粒在肝脏和脾脏中表现出高积聚性。
对于需要广泛肌肉编辑的疾病,如杜氏肌营养不良症(DMD),封装了Cas9 mRNA的LNPs十分有效。当与止血带结合使用时,静脉注射这些LNPs能够在小鼠的整个腿部肌肉中诱导编辑。这种方法相比病毒载体递送更有优势,可以降低免疫原性并具备可重复给药的能力。被动递送方法也被用于靶向实体肿瘤。增强渗透性和滞留(EPR)效应允许大分子在全身注射后在肿瘤微环境中积聚。含有Cas9 RNPs的PEG涂层纳米颗粒和金纳米棒已利用这一效应实现了对肿瘤的优先积聚。为了进一步增强肿瘤特异性靶向性,这些递送载体通常还结合了酸可降解或低氧响应的连接剂,这些连接剂在独特的肿瘤环境中促进Cas9 RNP的释放。
直接将含有CRISPR-Cas的LNPs注射到特定组织中,为基因编辑提供了又一种靶向方法,特别适用于那些难以通过静脉注射到达的组织。这种方法已被用于编辑小鼠模型中的多种组织,包括视网膜、内耳、角膜、肺和大脑。尽管已使用如Lipofectamine等商业转染试剂,但其细胞毒性限制了其临床潜力。研究人员正在开发专用于向特定组织(如神经视网膜和视网膜色素上皮)高效递送的特制LNPs。
在LNP之外,非脂质基纳米颗粒在递送CRISPR-Cas组分方面也显示出了潜力。CRISPR-Gold由覆盖有DNA寡核苷酸、Cas9或Cas12a核糖核蛋白(RNPs)以及阳离子内体裂解聚合物的金纳米颗粒组成,已在脑组织和肌肉中实现了有效的编辑。这种方法在治疗如脆性X综合征等疾病以及促进同源定向修复方面展现出了潜力。其他创新的纳米颗粒设计包括带有靶向配体和谷胱甘肽敏感交联的纳米胶囊,以及由与引导RNA部分互补的单链DNA组成的DNA纳米结。这些制剂已在包括视网膜、肌肉和肿瘤在内的各种组织中显示出了有效性。这些直接注射方法具有多种优势,包括局部编辑、减少系统性暴露以及相比基于DNA的载体,基因组编辑机制可能具有更短暂的表达潜力。然而,每种方法都有其自身的局限性和特定应用,这凸显了持续研究和开发针对CRISPR-Cas基因组编辑的靶向递送系统的必要性。将Cas9 RNP或mRNA封装在纳米颗粒中可以克服与免疫原性和细胞内递送相关的问题。LNP经过数十年的深入研发,特别是在COVID-19大流行的推动下,其临床转化进程显著加速。多款基于LNPs的mRNA疫苗的快速研发、FDA的批准以及广泛部署,不仅彰显了这一递送策略的安全性、高效性和可扩展性,数十亿剂疫苗的成功生产与分发,也是基于LNPs的mRNA基因组编辑器的安全性、商业可行性的有力证明。参考文献:
Tsuchida CA, Wasko KM, Hamilton JR, Doudna JA. Targeted nonviral delivery of genome editors in vivo. Proc Natl Acad Sci U S A. 2024 Mar 12;121(11):e2307796121. doi: 10.1073/pnas.2307796121.
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。

























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论