默沙东将在2024 ESMO大会上发布10款在研或已获批产品的生存数据和新研究进展
帕博利珠单抗用于治疗早期女性癌症的总生存期(OS)数据发布,包括早期高危三阴性乳腺癌(KEYNOTE-522)和高风险局部晚期宫颈癌(KEYNOTE-A18),均被选入大会主席论坛
KEYNOTE-006研究10年OS数据和KEYNOTE-811研究最终OS数据发布,再次展示帕博利珠单抗对于特定晚期黑色素瘤和HER2阳性胃或胃食管结合部腺癌患者的重要作用
在ESMO大会上发布的数据凸显了公司抗体偶联物(ADC)在研管线进展,包括patritumab deruxtecan(HER3-DXd)、sacituzumab tirumotecan(sac-TMT)和ifinatamab deruxtecan(I-DXd)
该下一代CD3/CD19 双特异性抗体对于B细胞恶性肿瘤和自身免疫性疾病具有应用潜力
将增强并丰富默沙东的在研管线
美国新泽西州罗威市,2024年9月4日——默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)宣布,公司将在9月13日至17日期间于西班牙巴塞罗那举行的欧洲肿瘤内科学会(ESMO)大会上,发布来自公司产品组合和在研管线中涉及超过20个不同癌症种类的研究数据。其中被选入大会主席论坛环节的数据包括:早期高危三阴性乳腺癌III期KEYNOTE-522研究(#LBA4),高风险局部晚期宫颈癌III期 KEYNOTE-A18研究(#709O),以及不可切除的非转移性肝细胞癌III期LEAP-012研究(#LBA3)。此次大会上共有来自公司的80篇数据摘要发布,进一步彰显默沙东针对广泛产品组合和丰富在研管线持续推动临床研究的进展。
Eliav Barr 博士
默沙东实验室高级副总裁
全球临床开发负责人、首席医学官
过去十年来,来自帕博利珠单抗的研究数据已经促使一些致命癌症的治疗范式发生转变,并改写了医学教科书。今年9月4日是帕博利珠单抗在美国获得首次批准的十周年,我们倍感自豪,从不可切除或转移性黑色素瘤的10年生存数据,到两种类型的早期女性癌症的新总生存数据,帕博利珠单抗在今年ESMO大会上所发布的数据,正是其不凡发展历程的缩影。我们非常高兴展示通过广泛和多样化的管线数据,建立我们在肿瘤治疗领域的领导地位,以期造福更多患者。
此次大会上公司产品组合发布的数据将包括来自帕博利珠单抗1、belzutifan2、与卫材公司合作的仑伐替尼3和与阿斯利康公司合作的奥拉帕利4的全新或更新数据。
将在ESMO会议上公布的默沙东产品组合关键数据包括:
III期KEYNOTE-522研究首次发布总生存期(OS)数据,评估帕博利珠单抗联合化疗新辅助治疗,并在手术后继续单药辅助治疗用于早期高危三阴性乳腺癌患者(Presentation #LBA4; Presidential Symposium II: Practice-changing trials)
III期KEYNOTE-A18研究OS数据,评估帕博利珠单抗联合同步放化疗用于高风险局部晚期宫颈癌患者(Presentation #709O; Presidential Symposium I: Practice-changing trials)
III期LEAP-012研究首次中期分析结果发布,评估帕博利珠单抗及仑伐替尼联合TACE用于不可切除的非转移性肝细胞癌患者(Presentation #LBA3; Presidential Symposium I: Practice-changing trials)
III期KEYNOTE-006研究10年OS数据,评估帕博利珠单抗对比伊匹木单抗一线治疗晚期黑色素瘤患者(Presentation #LBA44; Mini oral session: Melanoma and other skin tumours)
III期KEYNOTE-811研究终期分析OS数据,评估帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性胃或胃食管结合部腺癌患者(Presentation #1400O; Proffered paper session 2: GI tumours, upper digestive)
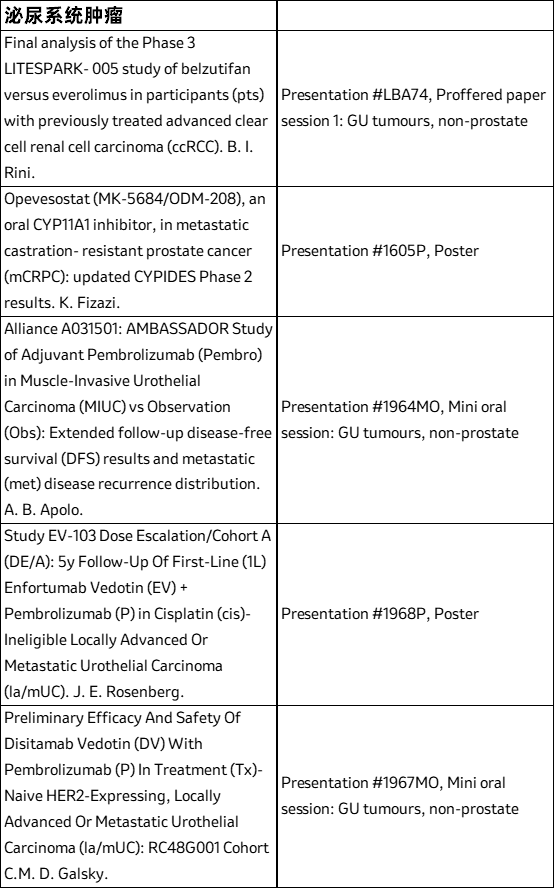
III期LITESPARK-005研究终期分析数据,评估belzutifan用于既往PD-1/L1抑制剂和VEGT-TKI治疗后进展的晚期肾细胞癌成人患者(Presentation #LBA74; Proffered paper session 1: GU tumours, non-prostate)
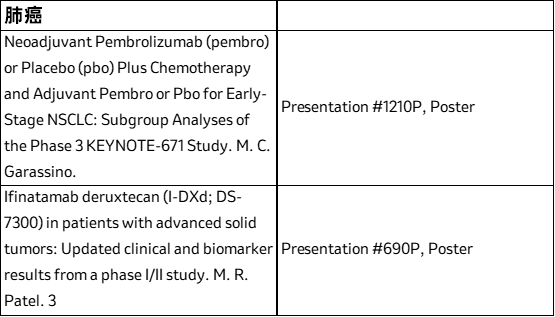
此外,将在大会上发布的在研管线数据包括与第一三共公司共同开发的靶向HER3 ADC药物patritumab deruxtecan(HER3-DXd)5和ifinatamab deruxtecan (I-DXd,MK-2400)6,与科伦博泰公司共同开发的在研靶向TROP2抗体偶联物(ADC)药物sacituzumab tirumotecan (sac-TMT,MK-2870/SKB264)7,以及与Orion公司合作的在研类固醇合成抑制剂opevesostat(MK-5684/ODM-208)8。
在ESMO会议上公布的在研管线关键摘要包括:
II期ICARUS-BREAST01研究数据,评估HER3-DXd用于激素受体(HR)阳性/HER2阴性晚期乳腺癌患者(Presentation #340O; Proffered paper session: Breast cancer, metastatic)
一项由科伦博泰公司独立负责在中国开展的II期研究首次公布数据,评估sac-TMT用于既往经治的晚期子宫内膜癌和卵巢癌患者(Presentation #715MO; Mini oral session 2: Gynaecological cancers)
一项由科伦博泰公司独立负责在中国开展的II期研究数据,评估sac-TMT联合帕博利珠单抗用于复发或转移性宫颈癌患者(Presentation #716MO; Mini oral session 2: Gynaecological cancers)
注释:
[1] 截至目前,国家药品监督管理局(NMPA)批准帕博利珠单抗下列适应证,除此以外其他适应证尚未获批:
适用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗;
联合培美曲塞和铂类化疗适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌的一线治疗;
适用于由国家药品监督管理局批准的检测评估为 PD-L1 肿瘤比例分数(TPS)≥1%的 EGFR 基因突变阴性和 ALK阴性的局部晚期或转移性非小细胞肺癌一线单药治疗;
联合卡铂和紫杉醇适用于转移性鳞状非小细胞肺癌患者的一线治疗;
单药用于通过充分验证的检测评估肿瘤表达 PD-L1(综合阳性评分(CPS)≥10)的、既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌患者的治疗;
联合铂类和氟尿嘧啶类化疗药物用于局部晚期不可切除或转移性食管或胃食管结合部癌患者的一线治疗;
单药用于由国家药品监督管理局批准的检测评估肿瘤表达 PD-L1(CPS≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌患者的一线治疗;
单药用于 KRAS、NRAS 和 BRAF 基因均为野生型,不可切除或转移性高微卫星不稳定性(MSI-H)或错配修复基因缺陷型(dMMR)结直肠癌(CRC)患者的一线治疗;
联合铂类和氟尿嘧啶类化疗药物用于局部晚期不可切除或转移性食管或胃食管结合部癌患者的一线治疗;
单药用于既往接受过索拉非尼或含奥沙利铂化疗的晚期肝细胞癌(HCC)患者的治疗;
联合吉西他滨和顺铂用于局部晚期或转移性胆道癌(BTC)患者的一线治疗;
联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的早期高危三阴性乳腺癌(TNBC)患者的治疗;
单药用于不可切除或转移性微卫星高度不稳定型(MSI-H)或错配修复基因缺陷型(dMMR)成人晚期实体瘤患者:
‐ 既往接受过氟尿嘧啶类、奥沙利铂和伊立替康治疗后疾病进展的结直肠癌患者;
‐ 既往治疗后疾病进展且无满意替代治疗方案的其他实体瘤;
联合含氟尿嘧啶类和铂类药物化疗用于局部晚期不可切除或转移性HER2-阴性胃或胃食管结合部腺癌患者的一线治疗;
联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥1)的局部晚期不可切除或转移性HER2阳性胃或胃食管结合部腺癌患者的一线治疗。
[2] 截至目前,belzutifan 尚未获 NMPA 批准
[3] 截至目前,NMPA 批准仑伐替尼下列适应证,除此以外其他适应证尚未获批:
[4] 截至目前,NMPA 批准奥拉帕利下列适应证,除此以外其他适应证尚未获批:
单药用于携带胚系或体细胞BRCA突变(gBRCAm或sBRCAm)的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗
联合贝伐珠单抗用于同源重组修复缺陷(HRD)阳性的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗联合贝伐珠单抗治疗达到完全缓解或部分缓解后的维持治疗
单药用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗
单药用于携带胚系或体细胞BRCA突变(gBRCAm或sBRCAm)且既往治疗(包括一种新型内分泌药物)失败的转移性去势抵抗性前列腺癌成人患者的治疗。该适应症是基于PROfound 临床研究中BRCA 突变且既往治疗失败的转移性去势抵抗性前列腺癌受试者的分析结果给予的附条件批准。该适应症的完全批准将取决于后续开展临床试验证实本品在中国人群的临床获益
[5] 截至目前,patritumab deruxtecan尚未获 NMPA 批准
[6] 截至目前,ifinatamab deruxtecan尚未获 NMPA 批准
[7] 截至目前,sacituzumab tirumotecan尚未获 NMPA 批准
[8] 截至目前,opevesostat尚未获 NMPA 批准
09-2024-CN-KEY-17137
若您想了解更多有关疾病知识的信息,请咨询医疗卫生专业人士
癌症的早期发现与治疗有助于患者实现更大机会的长生存。目前许多癌症在疾病早期阶段被认为是可被治疗以及可能实现治愈的。基于对帕博利珠单抗治疗多种晚期癌症的理解,默沙东正进行约30项注册研究,探索公司产品组合和在研管线用于多种早期癌症的治疗。
2018 年 3 月,卫材与默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)通过旗下子公司开展战略合作,在全球范围对仑伐替尼进行共同临床开发和商业推广。根据协议,双方将就仑伐替尼单药或联合默沙东 PD-1 抑制剂帕博利珠单抗进行联合临床开发、生产和商业推广。卫材与默沙东正通过LEAP 系列临床项目中涉及多个癌症种类的多个临床试验评估仑伐替尼和帕博利珠单抗的联合使用。
2017 年 7 月,阿斯利康与默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)宣布在全球范围内达成一项肿瘤领域战略合作,共同对包括全球首个 PARP 抑制剂奥拉帕利在内的特定肿瘤产品就多个癌症种类进行临床开发和商业推广。双方将携手研发这些产品与其他潜在新药的联合治疗以及单药治疗方案。同时,两家公司还将独立开发这些产品与各自旗下的 PD-L1 及 PD-1 抑制剂的联合治疗方案。
安斯泰来和Seagen与默沙东公司共同签署了一项临床合作协议,以评估安斯泰来和Seagen的enfortumab vedotin-ejfy与默沙东的帕博利珠单抗联合用药治疗此前未接受过治疗的局部晚期或转移性尿路上皮癌成人患者的疗效。辉瑞公司于2023年12月14日完成了对于Seagen的收购。
2023年10月,第一三共与默沙东达成一项全球合作,除在日本第一三共保留独家权利外,共同对patritumab deruxtecan (HER3-DXd),ifinatamab deruxtecan (I-DXd) 和raludotatug deruxtecan (R-DXd)进行临床开发和商业推广。第一三共将全权负责产品生产和供应。
在默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号),我们齐心协力追求共同的目标:我们发挥前沿科学的力量,在全球范围内拯救生命、改善生活。130多年来,我们通过研发重要药物和疫苗,为全人类带来希望。我们致力成为顶尖的研究密集型生物制药公司——当下,我们正处于研发前线,推出创新解决方案,以推进人类和动物疾病的预防和治疗。我们建立了一个多元、包容的全球员工体系,以负责的态度经营每一天,确保所有人、所有社区都能有一个安全、可持续和健康的未来。更多信息,请访问www.msd.com,并在X(前身为Twitter)、LinkedIn和Youtube平台关注我们。
中国是默沙东全球增长战略中至关重要的一部分。默沙东中国总部设在上海,同时在北京设有研发中心、在杭州、宁波和天津分别设有工厂,实现了研发、制造和商业运营三擎合一。我们全心全意,向中国大众提供高质量的创新药品、疫苗和服务,造福中国社会。更多信息,敬请访问默沙东中国官网,或关注默沙东中国在微信上的官方社交媒体账号。
默沙东是美国新泽西州罗威市默克公司的公司商号(下称“公司”)。本新闻稿包含根据《1995 年美国私人证券诉讼改革法案》之安全条款而做出的“前瞻性声明”。本文内容基于公司管理层当前的看法和预期,并且受制于可能出现的重大风险和不确定因素。默沙东不保证在研产品能获得所需的监管部门批准或取得商业成功。如果相关假设与现实有所出入、出现风险,或发生不确定情况,实际结果可与前瞻性声明中的预期有实质上的差异。
风险和不确定因素包括但不仅限于一般行业情况与竞争、一般经济因素(包括利率与汇率浮动)、美国及其他国家制药行业监管以及医疗政策的影响、全球范围内控制医疗成本的趋势、技术发展、竞争对手获得的新产品与专利、新产品开发固有的挑战(包括获得监管部门批准)、默沙东对未来市场形势做出准确预测的能力、生产上的困难或迟延、国际经济金融状况不稳定与主权风险、对默沙东专利和其它创新产品保护的有效性的依赖程度,以及公司面临专利诉讼和/或监管行动的风险。
默沙东没有义务就新信息、未来事件或其它原因对任何前瞻性声明进行公开的更新。尚有其它因素可能导致实际结果与前瞻性声明存在实质性差异,请参见默沙东2023年年报10-K报表以及公司在美国证券交易所备案的其它文件(可在美国证券交易所网站www.sec.gov上查阅)。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论