武田TAK-861片获1类创新药拟纳入突破性治疗品种
9月6日),中国国家药监局药品审评中心(CDE)官网最新公示,武田(Takeda)TAK-861片拟纳入突破性治疗品种,针对适应症为发作性睡病1型(NT1)。公开资料显示,TAK-861是一种口服食欲素受体2(OX2R)激动剂。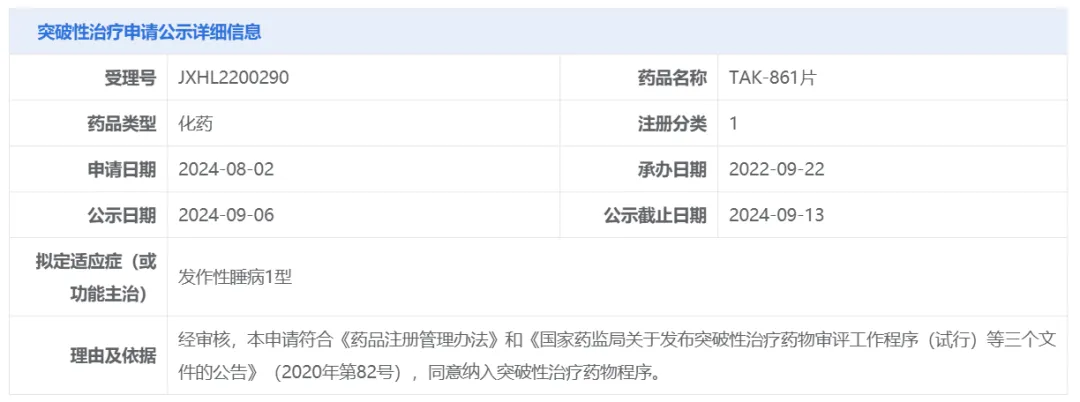
NT1是一种慢性、罕见的中枢神经系统过度嗜睡障碍,由于食欲素(orexin)神经元的大量丧失,导致大脑和脑脊液中食欲素神经肽水平低下。NT1患者会出现过度白天嗜睡(EDS)、猝倒、夜间睡眠中断、入睡和醒来时的幻觉等症状。这些衰弱症状显著降低生活质量,并严重影响患者工作、生活和人际关系。
TAK-861旨在通过选择性刺激食欲素受体来解决NT1中的食欲素缺乏问题。激活食欲肽2受体的激动剂可能替代内源性食欲肽,激活促进清醒的信号通路。
100%疾病控制率,可穿越血脑屏障,罗氏1类癌症新药拟纳入突破性治疗品种

截图来源:CDE官网
近年来,小分子酪氨酸激酶抑制剂(TKIs)在治疗脑转移中的潜力获得关注。ZN-A-1041正是一款靶向人表皮生长因子受体2(HER2)的口服选择性酪氨酸激酶抑制剂,同时具备高度血脑屏障通透性,可潜在用于治疗HER2阳性乳腺癌脑转移的患者以及预防脑转移的发生。

2023年美国临床肿瘤学会(ASCO)年会披露了ZN-1041的临床前和早期临床数据。ZN-A-1041-101是一项正在进行的1期、多中心、开放标签研究,评估了HER2+脑转移乳腺癌(BCBM)患者中,ZN-1041单药治疗的首次人体剂量递增评估,以及ZN-1041联合卡培他滨和曲妥珠单抗的剂量递增和扩展期评估,主要目标是安全性和耐受性。次要目标包括药代动力学和抗肿瘤反应,包括RECIST 1.1标准的客观缓解率(ORR)和RANO-BM标准的颅内ORR(iORR)。
研究结果显示,在19例至少两次肿瘤评估的脑转移乳腺癌(BCBM)患者中,ZN-1041联合卡培他滨和曲妥珠单抗的总ORR为78.9%, iORR为73.7%,疾病控制率(DCR)为100%。此外,根据RECISIT 1.1标准,6名患者完成了首次肿瘤评估,5名患者达到PR,1名患者达到SD。
“
行业洞见
SELECTED
系列文章精选
L司举报瓜
某器械公司营销总监被绑架后撕票
P司挖了N司的
扫码加入交流群
40000+行业菁英共同关注





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论