
GT201注射液在中国的1期临床研究中展现出良好的安全性和临床疗效,相关临床研究成果已经在2024年美国临床肿瘤学会年会(ASCO 2024)进行了展示(点击访问)。以下为GT201的简要介绍以及临床数据的总结。
TIL疗法在多种实体瘤中显示出良好的治疗效果,并显著延长了晚期患者的生存期。然而TIL细胞在大规模扩增过程中,会产生细胞功能降低或耗竭的情况,从而影响抗肿瘤效果和长期疗效。为此,沙砾生物设计了一种基因工程TIL产品GT201,该产品过表达一种提高T细胞功能的膜结合型IL-15复合物,从而增强TIL细胞的体内存续性和抗肿瘤能力。
GT201在设计上,不同于其他过表达分泌型或者膜结合型IL-15的细胞产品,选择了过表达膜结合型的IL-15/IL-15Ra复合物,该设计使得GT201在保持良好的安全性情况下,进一步提升其功能,从而提高在更多实体肿瘤适应症中的治疗效果。
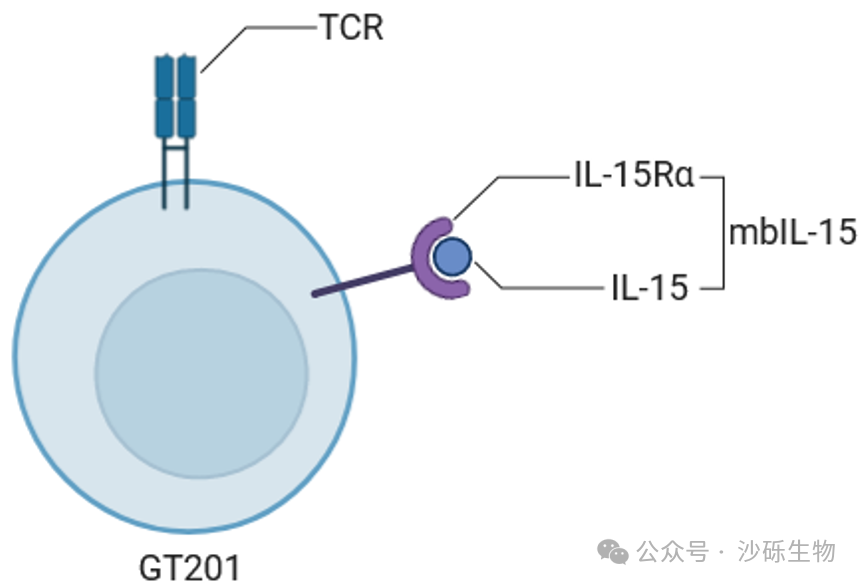
安全性方面,GT201安全性良好,未观察到与GT201 TIL细胞直接相关的SAE。所有不良反应在14天内消失、或降为2级或更低。临床疗效方面,多例患者的肿瘤明显缩小且病情缓解,其中一名患者接受GT201治疗后,肿瘤相比治疗前减少了69%。在所有的非小细胞肺癌患者中,GT201的疾病控制(肿瘤部分消除或病情稳定超过24周)率达到100%。另外在细胞存续方面,输注GT201的TIL后,T细胞在所有患者中稳定扩增,并且GT201细胞在患者体内扩增并存续的时间超过6个月。对于多线治疗的晚期或转移实体瘤患者,沙砾生物的GT201注射液展示出可控的安全性和良好的临床疗效。
▌文章来源:沙砾生物




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论