2024年8月,沙砾生物的全球首款膜结合IL-15复合物编辑型TIL(肿瘤浸润淋巴细胞)产品GT201注射液,取得重要里程碑式进展。近日,GT201继2023年7月获批中国IND后,又接连获得了美国FDA的IND批准,开启了沙砾生物在美国海外市场开展临床试验的新篇章。

GT201注射液在中国的1期临床研究中展现出良好的安全性和临床疗效,相关临床研究成果已经在2024年美国临床肿瘤学会年会(ASCO 2024)进行了展示(点击访问)。以下为GT201的简要介绍以及临床数据的总结。
TIL疗法在多种实体瘤中显示出良好的治疗效果,并显著延长了晚期患者的生存期。然而TIL细胞在大规模扩增过程中,会产生细胞功能降低或耗竭的情况,从而影响抗肿瘤效果和长期疗效。为此,沙砾生物设计了一种基因工程TIL产品GT201,该产品过表达一种提高T细胞功能的膜结合型IL-15复合物,从而增强TIL细胞的体内存续性和抗肿瘤能力。
GT201在设计上,不同于其他过表达分泌型或者膜结合型IL-15的细胞产品,选择了过表达膜结合型的IL-15/IL-15Ra复合物,该设计使得GT201在保持良好的安全性情况下,进一步提升其功能,从而提高在更多实体肿瘤适应症中的治疗效果。
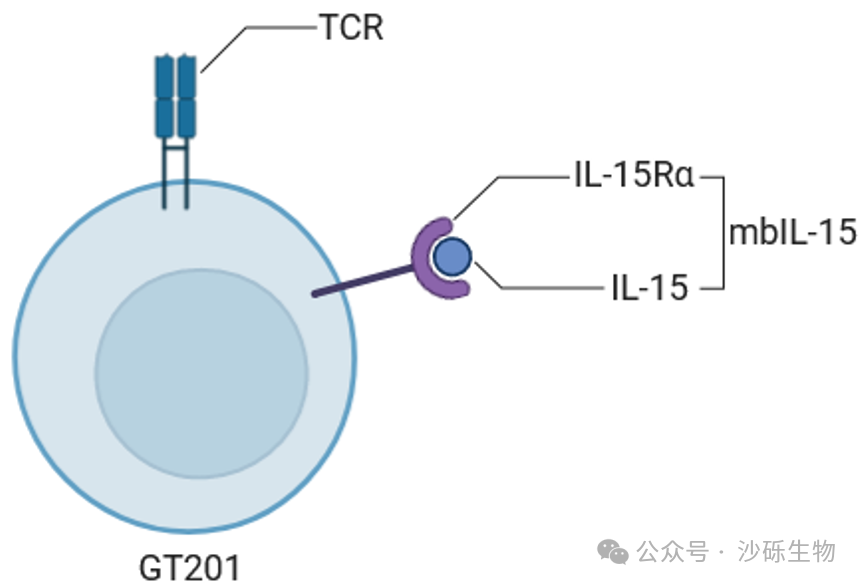
Fig: GT201的结构设计示意图
安全性方面,GT201安全性良好,未观察到与GT201 TIL细胞直接相关的SAE。所有不良反应在14天内消失、或降为2级或更低。临床疗效方面,多例患者的肿瘤明显缩小且病情缓解,其中一名患者接受GT201治疗后,肿瘤相比治疗前减少了69%。在所有的非小细胞肺癌患者中,GT201的疾病控制(肿瘤部分消除或病情稳定超过24周)率达到100%。另外在细胞存续方面,输注GT201的TIL后,T细胞在所有患者中稳定扩增,并且GT201细胞在患者体内扩增并存续的时间超过6个月。
对于多线治疗的晚期或转移实体瘤患者,沙砾生物的GT201注射液展示出可控的安全性和良好的临床疗效。
与此同时,沙砾生物的另一项非基因编辑的GT101注射液,也已经在中国正式开启关键II期临床研究,后续将在全国多家临床中心陆续进行复发或转移性宫颈癌受试者招募;沙砾生物的GT201等其它管线,也正在全国各地的医院研究中心招募转移/复发晚期实体瘤患者。
如果您想进一步了解,关于沙砾生物TIL细胞治疗临床试验的更多情况,我们会详细向您进行讲解。
联系人:张老师
联系电话:021-58816212
联系时间:工作日早9点至晚5点
关于沙砾生物
沙砾生物成立于2019年,是一家专注于肿瘤免疫细胞治疗,以TIL药物为代表研发管线的创新型医药公司。沙砾生物已完成多轮股权融资,得到了国内外多家知名创投基金的支持。
沙砾生物自主研发的GT101注射液是国内首个获批注册临床的TIL药物,目前进入关键二期临床试验。沙砾生物的全球首款膜结合IL-15复合物编辑型TIL产品GT201注射液,已经完成了中美临床双报。公司的核心研发平台包括StemTexp®干性TIL扩增技术平台、StaViral®病毒稳转株工艺、ImmuT Finder®免疫调节靶点发现平台、KOReTIL®高效基因敲除系统,并依托平台开发了一系列下一代基因编辑型TIL药物。沙砾生物拥有国际领先的技术储备和产业资源,旨在打造开创性的实体瘤细胞药物,为广大肿瘤病患带来新的希望。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论