2024年8月19日,合肥星眸生物科技有限公司(以下简称“星眸生物”)宣布其自主研发的基因治疗I类创新药“XMVA09注射液”的第2项新药临床试验(IND)申请已获得国家药品监督管理局(NMPA)批准。今年3月,XMVA09注射液针对湿性年龄相关性黄斑变性(wAMD)适应症的IND申请获得CDE临床默示许可,此次新批准的适应症为糖尿病性黄斑水肿(DME)。
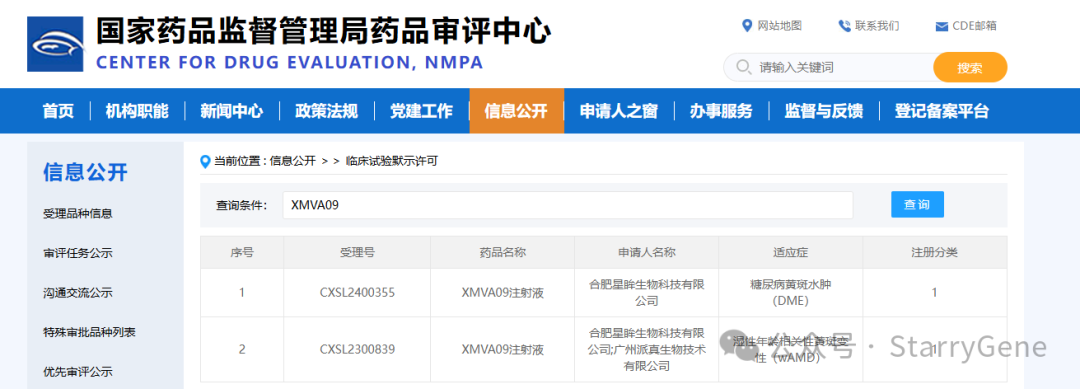
图片来源:CDE官网
糖尿病性黄斑水肿是糖尿病患者人群中一种常见的眼部并发症,主要影响视网膜中央的黄斑区域。黄斑是负责视觉清晰度的重要部位,当该区域发生水肿时,会导致视力下降甚至失明。治疗该眼部疾病的核心目标是维持并改善视力,临床治疗需求巨大。目前,抗血管内皮生长因子(anti-VEGF)是临床实践中最为安全、有效的治疗靶点。
XMVA09注射液是星眸生物自主研发的基因治疗药物,相比于传统抗体治疗药物1-3个月的注射周期,基因治疗药物可产生持续的治疗作用,有望实现一次注射便终身有效,极大地造福患者。XMVA09注射液采用全新的AAV衣壳,通过玻璃体腔内注射即可感染到紧贴脉络膜病灶的视网膜色素上皮层(RPE)细胞,为后续临床应用提供了更便捷的途径。此外,XMVA09注射液采用双抗设计,同时靶向血管内皮生长因子(VEGF)和血管生成素-2(ANG-2)双靶点,提高了药物的治疗效果,增加了对于VEGF不敏感患者的覆盖范围。
星眸生物创始人、CEO才源博士表示:“DME适应症的IND获批,是对XMVA09注射液研发潜力的有力证明。我们致力于通过创新科技,推动眼科疾病治疗的边界。这一成就标志着我们在实现这一愿景的道路上迈出了坚实的步伐。我们期待XMVA09注射液能够在临床实践中为患者带来更多的光明与希望!”
星眸生物首席医学官苗博龙博士表示:“XMVA09注射液在wAMD适应症的临床研究中已显示出良好的安全性和疗效,DME适应症的获批,进一步验证了我们药物的广泛适用性和治疗潜力。我们相信,DME新适应症的获批将进一步扩大我们服务患者的能力,为糖尿病性黄斑水肿患者提供更多的治疗选择。”

关于星眸生物

星眸生物是一家基于前沿基因编辑技术开发与眼科疾病基因治疗产品研发的高新技术企业,聚焦眼科基因治疗药物开发。星眸核心团队为“杰青”领衔的博士创业团队,在研发端团队拥有两大核心技术平台,AAV-抗体基因药物平台(双抗优化平台、衣壳筛选平台)和基因编辑平台。公司致力于中国人自主可用的眼科基因治疗药物,积极推进基因治疗向眼科大适应症进军,以眼科为突破口,尤其是年龄相关性黄斑变性为代表的常见眼科疾病为主要切入点,让中国人看得更久,看得更好。
E.N.D

往期文章推荐:
印度首例本土CAR-T治疗患者宣布“无癌”,费用仅需西方国家1/10
驯鹿生物CAR-T产品伊基奥仑赛注射液新增两项自免适应症IND获FDA许可
瑞金医院成功完成针对帕金森病AAV基因药物临床研究的上海首例受试者给药
总体缓解率达100%,国内这款CAR-T产品有望加速获批上市
首款上市TCR-T细胞疗法定价72.7万美元,年销售峰值或为4亿美元
CDE发布《嵌合抗原受体T细胞治疗淋巴血液系统恶性肿瘤临床试验技术指导原则(征求意见稿)》
完成超10亿元B轮融资,这家细胞疗法公司借助AI开发新一代细胞疗法
声明:内容来源于星眸生物官方,本文旨在知识共享,所有内容仅供参考,不构成任何建议。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论