
2024年8月1日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司宣布:胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽(研发代号:IBI362)的第二项新药上市申请(NDA)已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理,用于成人2型糖尿病患者的血糖控制。玛仕度肽是全球首个在2型糖尿病III期临床取得成功的GLP-1R/GCGR双重激动剂,有望助力中国广大糖尿病患者人群疾病管理,实现血糖控制、减重及心血管肾脏代谢指标的综合获益。
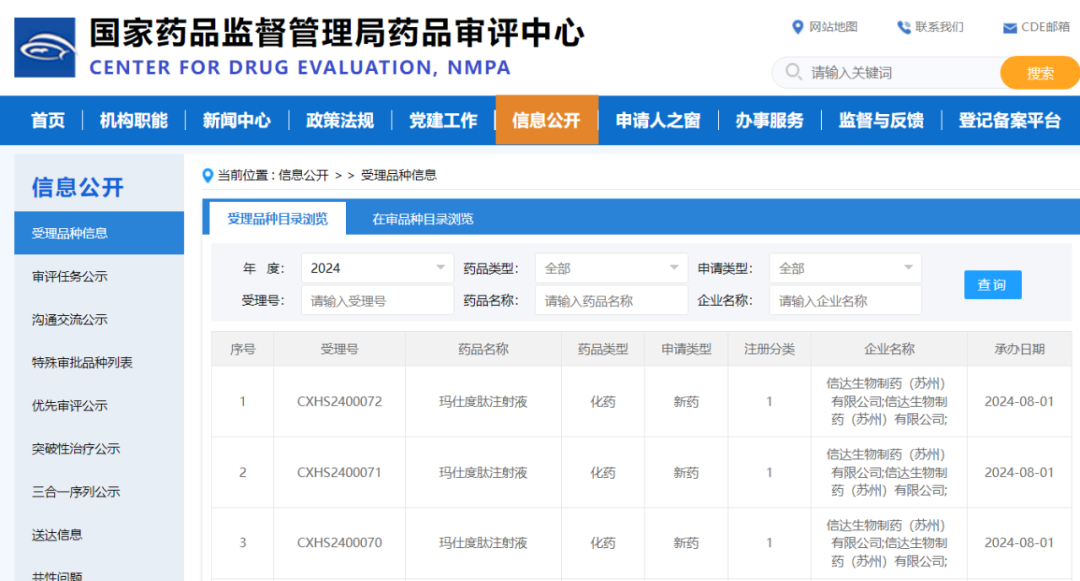
本次NDA申请主要基于两项III期临床研究的结果,分别在中国2型糖尿病受试者中验证玛仕度肽单药治疗(DREAMS-1,NCT05628311)和联合口服降糖药治疗(DREAMS-2,NCT05606913)的疗效和安全性。两项研究证明玛仕度肽在血糖控制和减重方面优效于安慰剂和度拉糖肽1.5 mg,同时均显示可改善多项心血管代谢,肝脏和肾脏相关指标。两项研究中,玛仕度肽的安全性与既往临床研究和其他GLP-1R激动剂相似,未发现新的安全性风险。详细的研究数据将于学术大会或学术期刊上发布。
信达生物制药集团临床副总裁钱镭博士表示:“作为全球同类首创也是开发进度最快的GLP-1R/GCGR双重激动剂,我们正积极推动玛仕度肽减重、降糖和其它适应症的开发。我们很荣幸在监管机构、研究者和受试者支持下,继减重适应症NDA获受理后,玛仕度肽用于治疗2型糖尿病的适应症NDA再获受理。玛仕度肽在中国2型糖尿病患者开展了多项临床研究,涵盖了单药治疗和多种口服药物失效两个最大的糖尿病人群,均展示了出色的降糖、减重双重优势,并带来心血管,肝脏和肾脏相关多项代谢获益,以及展现了良好的安全性。这为基于GLP-1R/GCGR双靶点的新一代GLP-1类药物治疗2型糖尿病提供了重要的循证医学证据,具有重要的临床意义。我们将积极配合监管部门,期待早日为我国2型糖尿病患者提供更好的治疗选择,助力血糖、体重及心血管肾脏代谢指标的综合改善与全面达标。”
据国际糖尿病联盟2021年发布的全球糖尿病概览,中国糖尿病患者人数居世界第一,预估2021年超1.4亿人,2045年超1.74亿人[1]。血糖控制不佳会导致不可逆的微血管和大血管并发症如视力下降、失明、肾功能不全、外周神经病变、心肌梗死、中风和截肢等[2]。糖尿病发病率高、隐匿性强、并发症严重,这三大特征严重威胁着人类的健康。目前针对糖尿病的治疗方案较多,新型降糖类药物的开发除有效控制血糖外,也在探索对糖尿病患者在减轻体重、降低心血管风险、保护肾脏等方面的额外获益[3]。
玛仕度肽(IBI362)是信达生物与礼来制药共同推进的一款胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动GLP-1R促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。玛仕度肽已在多项临床研究中展现出优秀的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。
玛仕度肽当前共有两项NDA获NMPA受理审评,包括:
玛仕度肽当前共开展了五项III期临床研究,包括:
在中国超重或肥胖受试者中开展的III期临床研究(GLORY-1);
在中国中重度肥胖受试者中开展的III期临床研究(GLORY-2);
在初治的中国2型糖尿病患者中开展的III期临床研究(DREAMS-1);
在口服药物治疗血糖控制不佳的中国2型糖尿病受试者中开展的对比玛仕度肽和度拉糖肽的III期临床研究(DREAMS-2);
在中国2型糖尿病合并肥胖的受试者中开展的对比玛仕度肽和司美格鲁肽的III期临床研究(DREAMS-3)。
其中,GLORY-1、DREAMS-1和DREAMS-2研究均已达成终点。
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的使命和目标。信达生物成立于2011年,致力于开发、生产和销售肿瘤、代谢及心血管、自身免疫、眼科等重大疾病领域的创新药物。公司已有10款产品获得批准上市,同时还有4个品种在NMPA审评中,4个新药分子进入III期或关键性临床研究,另外还有18个新药品种已进入临床研究。公司与海内外药企深入合作加速药物创新,与礼来、罗氏、赛诺菲、Adimab、Incyte和MD Anderson癌症中心等国际合作方达成30多项战略合作。
信达生物在不断开发创新药物、谋求自身发展的同时,始终心怀科学善念,坚守“以患者为中心”,心系患者并关注患者家庭,积极履行社会责任。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
详情请访问公司网站:www.innoventbio.com或公司领英账号Innovent Biologics。
声明:信达生物不推荐未获批的药品/适应症的使用。
[1] Sun H, Saeedi P, Karuranga S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projects for 2045 [published correction appeals in Diabetes Res Clin Pract. 2023 Oct; 204: 110945]. Diabetes Res Clin Pract. 2022; 183: 109119. doi: 10.1016/j.diabres.2021. 109119[2]Gregg EW, Sattar N, Ali MK. The changing face of diabetes complications. Lancet Diabetes Endocrinol. Published online 2016. doi: 10.1016/S2213-8587 (16) 30010-9[3] Nauck MA, Quast DR, Wefers J, Meier JJ. GLP-1 receptor agonists in the treatment of type 2 diabetes-state-of-the-art. Mol Metab. Published online 2020. doi: 10.1016/j.molmet.2020. 101102本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用“预期”、“相信”、“预测”、“期望”、“打算”及其他类似词语进行表述时,凡与本公司有关的,均属于前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述是基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些是超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
本公司、本公司董事及雇员代理概不承担 (a) 更正或更新本网站所载前瞻性表述的任何义务;及 (b) 若因任何前瞻性表述不能实现或变成不正确而引致的任何责任。

<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论