
作为一个新赛道,细胞与基因治疗(CGT)产业的发展备受关注。从大的范畴来看,细胞疗法属于免疫疗法。近十年,免疫疗法的出现,成为癌症研究最热门的领域之一。这种利用自身免疫细胞杀灭癌细胞的方式比传统治疗更安全有效,既让肿瘤患者看到了“治愈”的希望,也让肿瘤治疗步入全新时代。
更值得振奋的是,除了免疫检查点抑制剂,多种细胞免疫疗法相继获批上市,给癌症患者带来了新的选择和希望,这也意味着使用自身免疫细胞杀灭肿瘤逐渐成为现实。常见的免疫细胞治疗包括DC、CIK、CAR-T、TCR-T、NK、NKT、CAR-NK、TILs等。
如今,2024年走过半程,来自CGT赛道的张江企业上半年都取得了哪些研究成果?


张江细胞治疗企业晒出靓丽“成绩单”

01 CAR-T
今年3月1日,位于张江金山生物医药产业园的科济药业宣布,国家药品监督管理局(NMPA)已正式批准针对BCMA的自体CAR-T候选产品泽沃基奥仑赛注射液(商品名:赛恺泽®)的新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。

(图片来源:科济药业官网)
6月17日,科济药业又在第29届欧洲血液学协会(EHA 2024)年会上进行报告,披露赛恺泽®以及靶向G蛋白偶联受体C组5成员D(GPRC5D)的自体CAR-T细胞候选产品CT071的最新研究成果:
正在进行的I/II期研究LUMMICAR-1的II期队列(n=102)的初步结果显示,在既往经过至少3线治疗的R/R MM患者中,赛恺泽®具有令人信服的疗效和可接受的安全性。
CT071采用CARcelerateTM平台制造,该平台通过将制造过程缩短至约30小时,大幅缩短了从静脉到静脉的时间,且使T细胞更年轻。这项首次人体单臂开放标签探索性临床试验旨在评估CT071在R/R MM患者中的安全性和有效性。
4月24日,西比曼宣布公司旗下肿瘤免疫疗法管线C-CAR031的临床研究成果入选2024年美国临床肿瘤学会(2024 ASCO)年会。报告显示:C-CAR031在经过多线治疗的晚期肝癌(HCC)患者中(先前接受过1-6线治疗)中可控的安全性和令人鼓舞的抗肿瘤活性。
C-CAR031是一种针对HCC的自体抗磷脂酰肌醇蛋白聚糖3(GPC3)的装甲型CAR-T疗法。基于阿斯利康新型的GPC3靶向CAR-T,该疗法由阿斯利康的转化生长因子-β受体II(TGFβRII)显性负装甲发现平台设计、并由西比曼在中国生产。
“我们对C-CAR031在HCC患者中的首次临床结果感到鼓舞。今天呈现的早期数据提供了令人信服的概念验证,有望重新定义HCC和其他GPC3表达实体肿瘤的治疗模式。”西比曼生物董事长兼首席执行官刘必佐表示。
6月28日,国家药监局药品审评中心(CDE)官网显示,优卡迪自主研发的U87注射液新药临床试验(IND)申请正式获得默示许可,其适应症为Trop2阳性晚期恶性肿瘤。
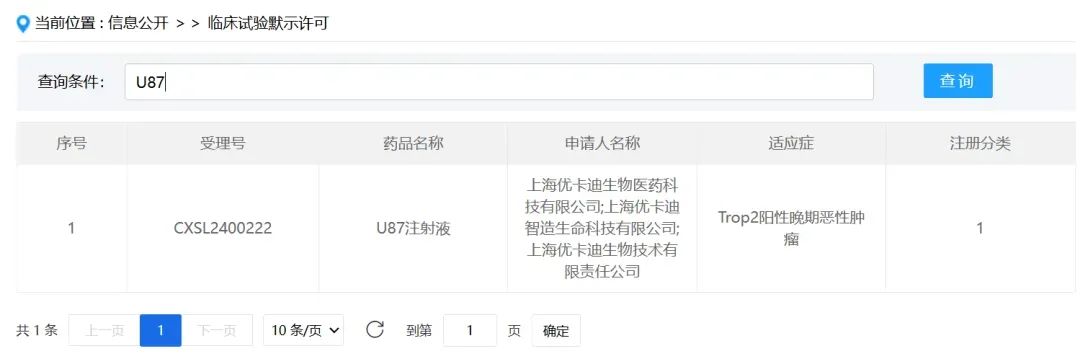
(图片来源:CDE官网)
U87注射液是优卡迪自主研发的具有完全自主知识产权的1类治疗用细胞治疗产品。目前,全球暂无靶向Trop2的CAR-T细胞治疗药物获批上市,U87注射液此次临床试验获批将为Trop2阳性晚期恶性肿瘤患者带来新的希望和治疗选择。
作为全球首款全人源靶向Trop2 CAR-T产品,U87注射液是基于优卡迪MADDS抗体创新成药性技术平台开发的创新型CAR-T产品,有望为三阴性乳腺癌、肺癌、胰腺癌、结直肠癌、甲状腺癌等晚期实体瘤患者带来新的希望。
02 CAR-NK
2月7日,先博生物自主研发的靶向CD19的CAR-NK细胞注射液正式获得CDE的临床默示许可,适应症为中重度难治性系统性红斑狼疮(SLE)。这是SLE适应症在国内首个通用型NK产品获批IND,临床进度甚至有望成为全球领先。

(图片来源:先博生物官网)
先博生物通过研发通用型CAR-NK疗法,与其他创新细胞治疗产品相比显著降低患者的经济负担并且即时可用,叠加NK细胞突出的安全性优势,让NK疗法有望在不断发展的自身免疫性疾病领域脱颖而出。
5月22日,由恩凯赛药独立自主研发的基因修饰自然杀伤细胞注射液(产品代号:NK042)获得CDE批准开展临床试验。NK042是异体外周血来源的通用型基因修饰NK细胞注射液,具备治疗实体瘤、血液肿瘤及非肿瘤类疾病的潜力。此次I期临床的适应症为多种实体瘤。
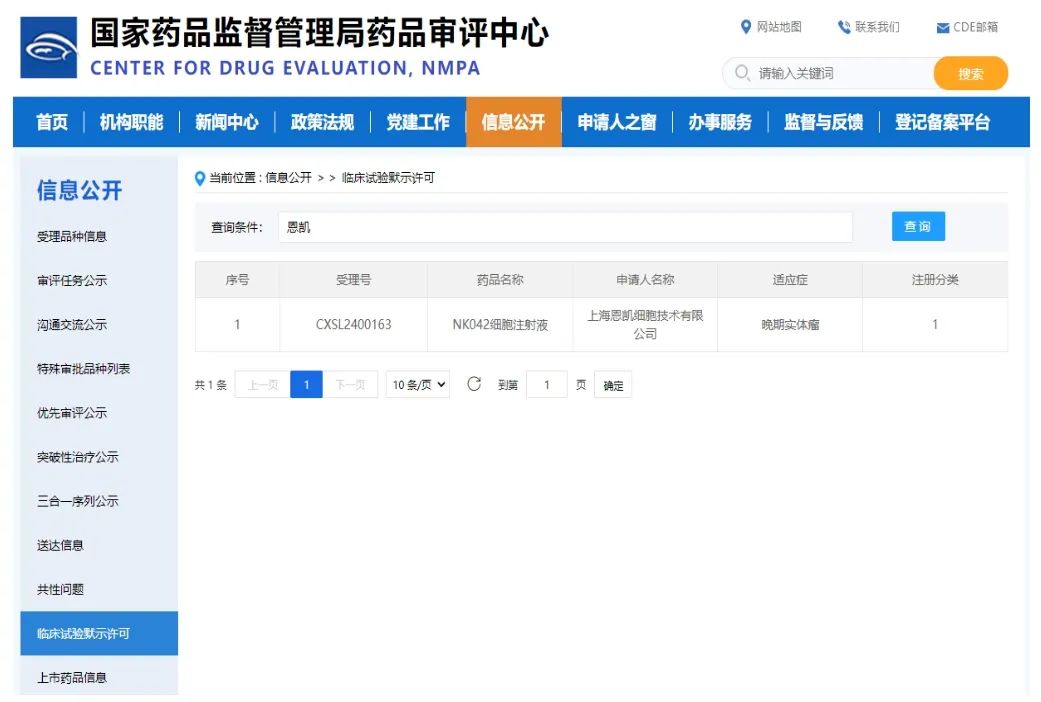
(图片来源:CDE官网)
中国工程院&欧洲科学院双院士、恩凯赛药创始人田志刚教授介绍:“作为恩凯赛药的核心临床管线产品,NK010和NK042两款产品均具有广谱应用潜力,我们期待着这两款NK细胞注射液能为肿瘤治疗方案带来创新和突破,使患者早日受益。”
03 TCR-T
TCR-T细胞治疗是过继性T细胞疗法的一种,其原理是从病人体内提取T淋巴细胞,通过人为的扩增,再回输到病人体内,从而达到“杀死”肿瘤的作用。
在张江,有一家致力于研发靶向实体瘤的细胞治疗企业——镔铁生物,其长期目标是发展一系列治疗胰腺癌等复发难治恶性肿瘤的TCR产品,识别共享基因突变和肿瘤新生抗原,将细胞治疗产品做到个性化与通用相结合,缩短细胞治疗产品制备周期,提高细胞治疗的有效性和可及性。
目前,镔铁生物拥有针对KRAS突变TCR-T、TAC-NK、TCR-ICE三大产品管线。其中,针对KRAS突变的TCR-T细胞治疗产品是该公司研发进度最快的产品,已完成TCR筛选、体外功能鉴定、体内药效试验,2021年在多个临床中心完成了多例患者的研究者发起的临床试验(适应症为晚期胰腺导管腺癌)。其官网显示:后续该产品将成为镔铁生物第一个申报IND的产品。
2023年10月,镔铁生物完成超亿元A轮融资,所募资金将用于加速推进针对KRAS G12V突变的新型TCR-T细胞治疗产品申请注册临床试验,以及多个后续创新管线的产品开发以及国际合作。
除了国内布局,张江细胞治疗企业也同步实施“出海”战略。7月1日,星汉德生物宣布,美国食品药品监督管理局(FDA)已批准其全新一代人乳头瘤病毒(HPV)特异性TCR-T细胞治疗产品SCG142 I/II期临床的IND申请。SCG142正在被开发用于治疗HPV相关实体瘤患者。

作为一款开发中的全球同类最佳新药,SCG142的核心技术是利用星汉德生物独家拥有的GianTCRTM技术平台成功筛选分离天然高亲和力HPV特异性TCR,并与嵌合开关受体相结合。
和传统TCR-T细胞疗法相比,SCG142可显著提升T细胞增殖能力和肿瘤抑制作用,对HPV-16和HPV-52基因型相关宫颈癌等多种肿瘤具有特异性的肿瘤杀伤作用,适用于HPV导致的多种恶性肿瘤,包括宫颈癌、口咽癌、头颈癌等。

平台和空间赋能,加速创新产品上市

细胞治疗的创新发展,也离不开平台和空间的助力:
7月3日,Cytiva(思拓凡)举办“基因药物创新发布会”,重磅推出Sefia细胞治疗生产平台和ELEVECTA稳转细胞系两款新品,并创新性分享脂质纳米颗粒(LNP)如何赋能CRISPR技术,以及高效的细胞培养方案,助力中国基因药物研发与生产者提升安全与效率,加速创新疗法的可及。

目前,在中国获批上市的5款CAR-T疗法均得到了Cytiva的支持。据悉,Cytiva最新发布的两款重磅新品,覆盖细胞治疗产品生产的全部环节,将进一步推动行业在创新药研发上的降本增效。
Cytiva还在本次发布会上分享了LNP(脂质纳米颗粒)与CRISPR(基因编辑疗法)技术强强联合的技术优势,以更加高效和安全的递送方式,维持高水平的细胞活性和功能,并降低基因编辑流程的操作时间,拓展基因编辑的使用场景,加速新型疗法的研发与商业化。
作为最有前景的治疗领域之一,中国基因药物领域正在迅速发展,国内临床管线种类日益丰富,涵盖了病毒载体疗法、细胞治疗、核酸药物和mRNA疗法等多个方向,针对遗传性疾病、肿瘤、罕见病等重大疾病领域,显示出巨大的治疗潜力和市场前景。
作为国内CGT产业的发展高地,张江早已在2019年推出了张江细胞产业园(2021年升级为张江细胞与基因产业园),其全新地标——张江基因岛也于去年11月正式投入运营。

张江基因岛
截至2023年12月底,全国累计有407项细胞、基因疗法的注册性临床试验获批,其中143项位于上海;张江共75项,获批项目数量占上海50%以上、占全国近20%。同时,这里还率先推出了中国首款和第二款CAR-T细胞药物,引领着细胞治疗领域的前沿探索。
作为统筹张江科学城细胞、基因产业发展的特色园区,张江细胞与基因产业园已发展成为国内最具创新活力的细胞与基因产业集聚区之一,汇聚企业涵盖细胞存储、研发、智造、应用、装备全产业链。

细数上半年张江企业在细胞治疗领域取得的进展,不少产品已在临床阶段显示出安全性和有效性。相信,在不久的将来,这些产品在平台、空间和政策助力下,将加速上市,尽快惠及广大肿瘤患者。

























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论