
本期开始将推送大家关于多肽口服中领域先进的Pipeline技术与进展(上&下)。
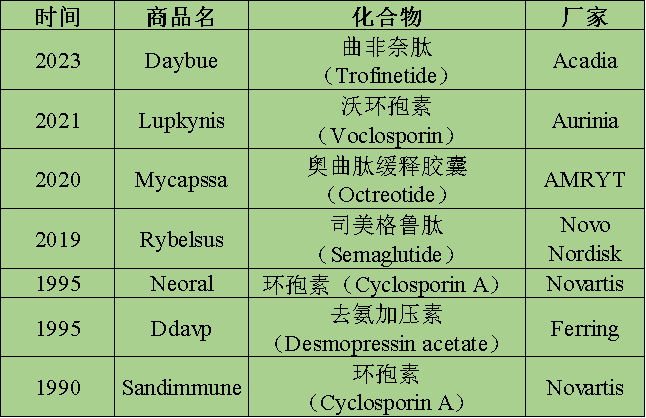
1990年FDA批准了全球第一个口服多肽药物(环状肽)药物环孢素A(Cyclosporin A,1200kDa)。这是一种免疫抑制剂,用于预防移植排斥反应和治疗自身免疫性疾病。经过了三十年的发展,目前已有多款口服肽类药物上市。
表1:上市口服多肽产品
多肽领域是目前资本寒冬下为数不多的一抹绿意。

图1:蛋白口服药物发展历程
口服药物递送的生化和物理屏障是“肽肽们”逆袭之路上的障碍,药品口服后会经过胃和小肠,这里环境的酸碱度、酶环境和黏液层等都是蛋白类药物需要解决的障碍。过五关,斩六将,略显英雄本色。

图2:口服药物递送的生化和物理屏障,以及具有主要肠细胞类型的肠粘膜结构
口服Rybelsus和Mycapssa已经将司美格鲁肽(semaglutide音译,同索马鲁肽)和奥曲肽(Mycapssa)(分子量均大于1000Da)暴露于体循环中吸收,代表了口服可吸收肽制剂开发的重大成就。但是,口服生物利用度仍然只有1%左右。
口服多肽大分子吸收的挑战仍未被有效解决。
表2:司美格鲁肽(Rybelsus)和奥曲肽(Mycapssa)

新药方式口服生物利用度差的原因可以用Lipinski的五法则(分子量(MW)≤500,氢键供体(HBD)的数量≤5,氢键受体(HBAs)的数量≤10,辛醇-水分配系数(LogP)≤5)以及可旋转键的数量应小于 10 个,拓扑极表面积(TPSA)应小于 140 Å 2)来解释,事实上,大多数新药模式都属于中大分子的范畴,因此往往缺乏口服生物利用度(口服生物利用度高是小分子药物的最大优势之一)。
奥曲肽的化学结构和理化性质见下图,显然有悖于Lipinski的五法则。
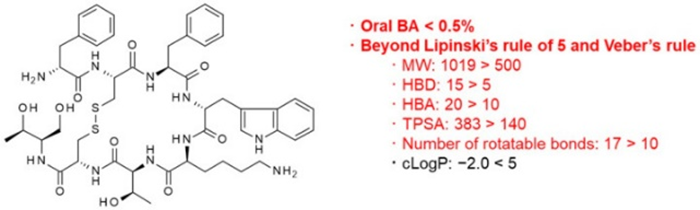
图3:奥曲肽的化学结构以及理化性质
2019 年,FDA 批准了用于治疗 2 型糖尿病的口服司美格鲁肽制剂。临床研究结果表明,口服40mg剂量与皮下注射1mg剂量的结局相似(NCT01923181),口服生物利用度仍的挑战仍未被有效解决。
尽管司美格鲁肽和奥曲肽利用度低,但也是目前上市口服多肽药物的集大成者。Rybelsus 是第一个基于促渗透策略的口服肽药物,以SNAC作为促渗透剂。
SNAC由Emisphere的Eligen™技术开发(见下文)(第一个使用SNAC商业化的产品是2015年被FDA批准上市的Eligen B12(维生素B12))。
与针对胃吸收的 Rybelsus 不同,Mycapssa 针对小肠中的药物吸收。Mycapssa胶囊涂覆甲基丙烯酸酯来防止奥曲肽在胃中的分解,胶囊中促渗剂主要是C8,辅以高浓度的附加添加剂(如PVP、单辛酸甘油酯和聚山梨醇酯80)来增加促渗透效应。
不同于Rybelsus ,Mycapssa是基于C8的TPE平台技术而来的重磅产品(见下文)。
针对口服生物利用度低的问题,主要的药物策略旨在增强肽和蛋白质的稳定性和吸收,包括修饰、改进配方以及采用贴片微针等一系列方式。
下图是目前多肽递送中先进的技术汇总。
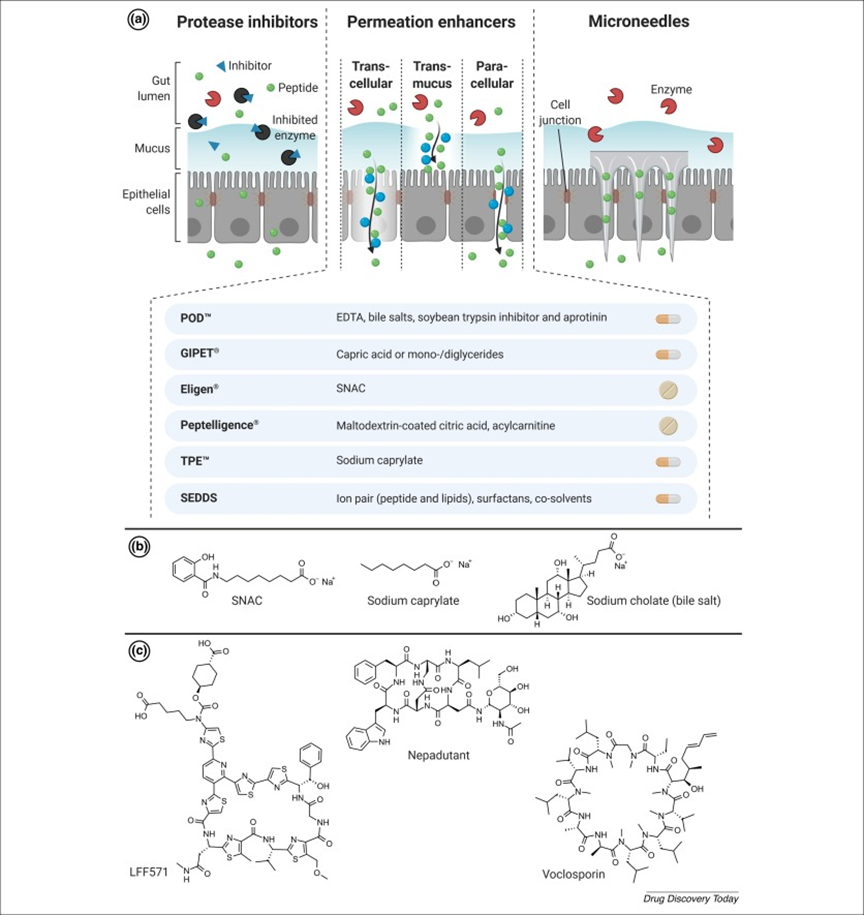
图4:多肽口服递送策略的示意图。(a)蛋白酶抑制剂、渗透增强剂和微针对肽的口服递送有效。(b)渗透增强剂成功地用于口服给药,如SNAC、胆盐和辛酸钠(它们使分子能够通过粘液层、细胞膜和紧密连接)。(c)化学修饰和环化是用于调节肽的理化性质的合适工具。
Oramed Pharmaceuticals Inc.开发了蛋白质口服递送(POD™)。在这个系统中,不同的策略共存于同一配方中:封装、渗透增强剂、螯合剂和蛋白酶抑制剂。Oramed的技术基于旨在通过胃肠道和增强吸收的组件。乙二胺四乙酸钠(EDTA)和胆盐可作为渗透增强剂。胶囊可保护胰岛素在胃中不被水解,而蛋白酶抑制剂(如大豆胰蛋白酶抑制剂和抑肽酶)可保护胰岛素免受蛋白酶降解,尤其是在小肠中。

图5:Oramed Pharmaceuticals Inc.的口服递送技术平台
Oramed公司目前有三条主要管线。

图6:Oramed Pharmaceuticals目前管线(官网)
Oramed公司应用POD技术开发的ORMD-0901(GLP-1类似物,将EDTA作为吸收促进剂使用)在模型猪及模型犬中均表现出良好的耐受性,且降血糖作用显著。
Oramed在临床上使用酶抑制剂方法进展最快是口服胰岛素ORMD-0801项目,Ⅲ期多中心临床试验结果表明,没有达到主要终点和次要终点便停止其后续的临床研究。

图7:Oramed Pharmaceuticals新闻稿(Oramed官网)
但是,Oramed完成了对试验数据的深入审查,分析发现具有特定参数(如体重指数(BMI)、基线HbA1c和年龄)的患者亚群对口服胰岛素反应良好。这些亚组的 HbA1c 降低超过 1%,经安慰剂调整,具有统计学意义,并且与 HTIT 试验中的患者群体非常接近。
Oramed表示开始与FDA进行讨论,并打算在美国启动一项 3 期口服胰岛素试验。

图8:Oramed Pharmaceuticals新闻稿(Oramed官网,2024年)
天汇生物(Oramed口服胰岛素胶囊营销权)表示国内外的3期临床方案不同,国内上市申请(受理号:CXSS2300021)已获得了国家药监局药品评审中心的受理。
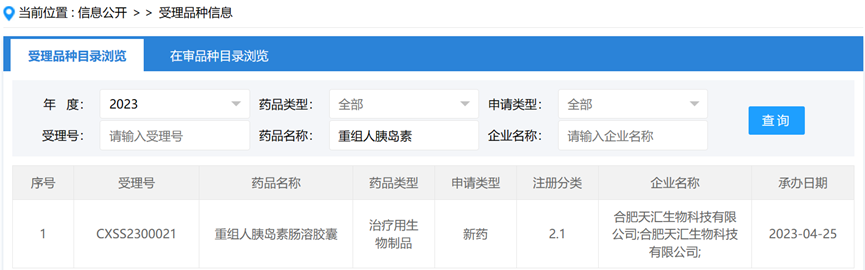
图9:重组人胰岛素胶囊信息(来源:CDE官网,https://www.cde.org.cn)
ORMD-0801在国内的临床剂量为1-3粒16mg胶囊(对照为安慰剂),主要终点为Hb1Ac相较基线的变化(24周)。推测ORMD-0801的国内三期临床已经获得了足够的阳性数据来支持其上市申请。
国内外ORMD-0801的临床进展的成功则会对目前多肽口服研究带来新革命,对市场而言则会带来新的冲击。毕竟,无数巨头在多肽口服领域折戟沉沙。
爱尔兰Merrion Pharmaceuticals Plc.开发了GIPET技术(胃肠渗透增强技术),该技术应用了中链脂肪酸作为渗透增强剂以促进肽类口服吸收。

图10:GIPET的作用机制
中链脂肪酸(MCFA)是一种天然来源的脂肪酸,长度约为 C6 至 C12,其中癸酸钠(C10)和C8被选为最有效的渗透增强剂(特别是C10)。

图11:癸酸钠(C10)和辛酸钠(C8)的结构
GIPET由三种含有表面活性物质的肠溶包被形式组成,以实现小肠吸收。第一种剂型(GIPET I)是一种肠溶片,由粉末形式的中链脂肪酸(MCFA)与选定重量比例的药物组合而成。

图12:GIPET I制造工艺示例
除此之外,GIPET II和III平台基于广泛可用的硬或软明胶胶囊的液体或半固体填充工艺。其中,第二种剂型(GIPET II)由油和表面活性剂与药物的微乳液预浓缩物组成,装在肠溶凝胶胶囊中(硬或软)。第三种为(GIPET III)由肠包被凝胶胶囊中的脂肪酸衍生物混合物组成。
GIPET由癸酸钠盐(sodium caprate,C10)组成,癸酸是一种可溶性阴离子表面活性剂,以肠溶包衣固体剂型递送(C10其已知的安全性,已被纳入批准的食品添加剂)。
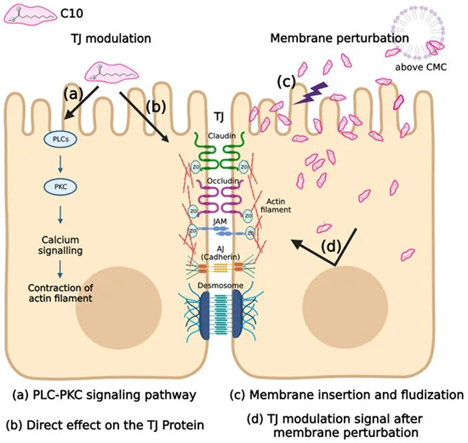
图13:关于C10机制的假设,它主要分为(左)紧密连接(TJ)调节(TJ 调节假说分为 Ca 2+ 依赖性 PLC-PKC 通路机制(a)和 Ca2+ 依赖性 TJ 蛋白调节(b))和(右)膜扰动机制(插入膜以流化膜并增强对跨细胞途径的吸收(c),以及由于膜扰动(d)引起的未知 TJ 调制信号)
临床试验已将GIPE技术应用于多种肽和蛋白质。
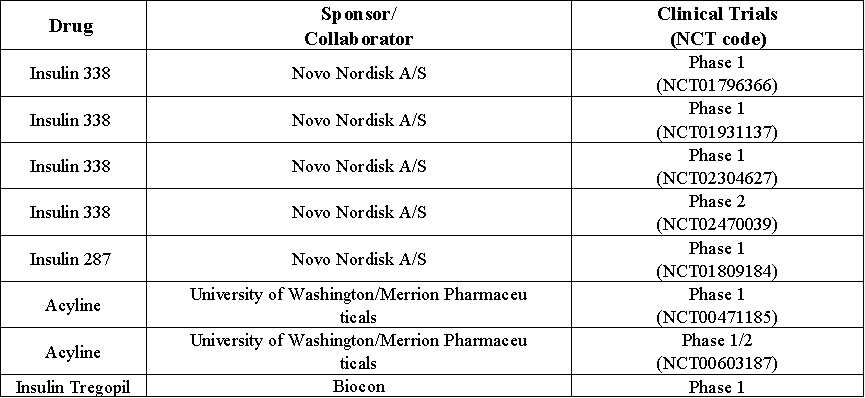
表3:C10口服制剂的临床研究
本节介绍了Oramed Pharmaceuticals Inc. 开发了蛋白质口服递送(POD™)和爱尔兰Merrion Pharmaceuticals Plc.开发了GIPET技术(胃肠渗透增强技术)平台。
Oramed Pharmaceuticals Inc. 酶抑制剂方法的口服胰岛素ORMD-0801是目前进展最快的项目(国内上市申请,受理号:CXSS2300021),而Merrion Pharmaceuticals Plc.开发的GIPET技术尚未有实质进展或关键临床数据。
后续将汇总部分上市口服多肽的管线与前沿技术。下篇:
参考文献:
1.Asano D, Takakusa H, Nakai D. Oral Absorption of Middle-to-Large Molecules and Its Improvement, with a Focus on New Modality Drugs. Pharmaceutics. 2023 Dec 28;16(1):47. doi: 10.3390/pharmaceutics16010047. PMID: 38258058; PMCID: PMC10820198.
2.Chen G, Kang W, Li W, Chen S, Gao Y. Oral delivery of protein and peptide drugs: from non-specific formulation approaches to intestinal cell targeting strategies. Theranostics. 2022 Jan 1;12(3):1419-1439. doi: 10.7150/thno.61747. PMID: 35154498; PMCID: PMC8771547.
3.Zizzari AT, Pliatsika D, Gall FM, Fischer T, Riedl R. New perspectives in oral peptide delivery. Drug Discov Today. 2021 Apr;26(4):1097-1105. doi: 10.1016/j.drudis.2021.01.020. Epub 2021 Jan 23. PMID: 33497830.
4.Kim JC, Park EJ, Na DH. Gastrointestinal Permeation Enhancers for the Development of Oral Peptide Pharmaceuticals. Pharmaceuticals (Basel). 2022 Dec 19;15(12):1585. doi: 10.3390/ph15121585. PMID: 36559036; PMCID: PMC9781085.
5.Walsh EG, Adamczyk BE, Chalasani KB, Maher S, O'Toole EB, Fox JS, Leonard TW, Brayden DJ. Oral delivery of macromolecules: rationale underpinning Gastrointestinal Permeation Enhancement Technology (GIPET). Ther Deliv. 2011 Dec;2(12):1595-610. doi: 10.4155/tde.11.132. PMID: 22833984.
6.Kim JC, Park EJ, Na DH. Gastrointestinal Permeation Enhancers for the Development of Oral Peptide Pharmaceuticals. Pharmaceuticals (Basel). 2022 Dec 19;15(12):1585. doi: 10.3390/ph15121585. PMID: 36559036; PMCID: PMC9781085.
7.公司官网
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论