目前在抗体类药物的生产过程中,纯化工艺有着非常重要的位置。从项目开始到抗体药上市对于纯化而言需要经历多个阶段,例如工艺开发,工艺放大与确认,IND临床样品生产,PC研究, PPQ以及商业化生产等,随着工艺不断的向前推进,实际上也是生产规模的一次次的放大,在放大的过程中往往伴随一些条件的变化,比如柱子直径的变化,容器类型的变化,样品放置时间的变化等等,这些变化会偶尔导致出现此前未出现的一些小概率事件,从而导致放大失败甚至是生产失败,以下列举了一些小概率事件。
01. 二硫键还原
近年来,随着高浓度哺乳动物细胞培养技术的发展,抗体链间二硫键还原现象变得更为常见,主要是受到硫氧还蛋白与硫氧还蛋白还原酶的影响。为了控制这种现象,下游有多种策略可供选择,如保持收获液通气操作,降低细胞收获液温度,缩短细胞收获液保存时间以及对深层过滤压力进行控制等,除此之外,有文献提到加入过氧化氢来抑制还原现象的产生。更有意思的是,也有研究表明,即使在收获期间抗体被还原,也可以在亲和捕获淋洗阶段经过氧化还原缓冲液的冲洗,被还原的抗体能够重新氧化为完整抗体。在图1中 Batch2保持收获液空气/氧气的操作,Batch1收获液没有通入任何气体,结果显示,Batch1在亲和收获后完整抗体比例很低,虽然后续层析步骤有所提升,但依然纯度不高;而Batch2在整个工艺过程中都能保持较高比例的完整抗体。图2中可以看到在亲和纯化过程中加入Wash2 氧化还原缓冲液淋洗步骤,可以将5%完整比例的抗体直接提升至93%的比例。然后通过Wash3缓冲液的冲洗来替换掉Wash2氧化还原剂组分,也不会影响后续的洗脱液。
而本文作者认为二硫键还原最大的痛点并不在于二硫键还原现象本身,因为现在已有许多措施能够解决此类问题。而真正的痛点在于在某些项目中二硫键还原只发生在放大以及生产阶段,甚至有些在生产阶段只出现亲和层析的第二个或后面几个循环中,然而在小试开发阶段并不会出现此现象,因此在确认工艺中并不会有抑制二硫键还原的措施。而小试与生产的差异原因推测可能是由于小试阶段样品的储存容器主要为开口瓶或开口袋子,其中的收获液可以与空气接触,而往往在生产阶段收获液主要保存于封口的储液袋中,处于无氧状态中,所以导致只在生产阶段出现二硫键还原现象,对此本公司也有彻底的解决办法。
图1
图2
02.阳离子洗脱峰双峰现象
阳离子的洗脱峰偶尔会出现双峰现象,这种现象并不是由于分辨高能够分离两种不同的组分,因为将两个峰的任一峰组分重新上柱且保持同样的纯化条件,依然会再次出现双峰现象。将两个峰进行纯度检测,我们会发现两个峰纯度是比较一致的。有文献研究表明,双峰现象出现的原因可能是填料结构,冲洗或洗脱条件的差异所导致,也有研究表明,双峰现象根本原因是蛋白质构象发生了改变。无论原因为何,双峰现象都可以通过优化填料种类,淋洗条件以及洗脱条件等得到解决。然而双峰现象的真正的麻烦并不在于此现象本身,而是在有些案例中小尺寸的柱子洗脱峰并不能出现双峰现象,而是会在更大尺寸或是生产规模的尺寸上才能展现出来,严重一些会导致生产收峰失败从而导致当批次生产失败。图3中比较了6款填料,其中Fractogel SO3,Eshmuno S,Nuvia S和POROS 50HS出现了明显的双峰,Source 30S和UNOsphere rapid S则不明显。在图4中可以看到盐浓度不同,洗脱pH不同双峰分布也不同,表明通过优化洗脱条件也可以抑制双峰现象。在图5中可以看到柱直径为1.1cm的时候出现双峰现象(0.5cm柱子上未出现,未展示),当改变淋洗条件后双峰消失,只剩唯一的洗脱峰。
图3
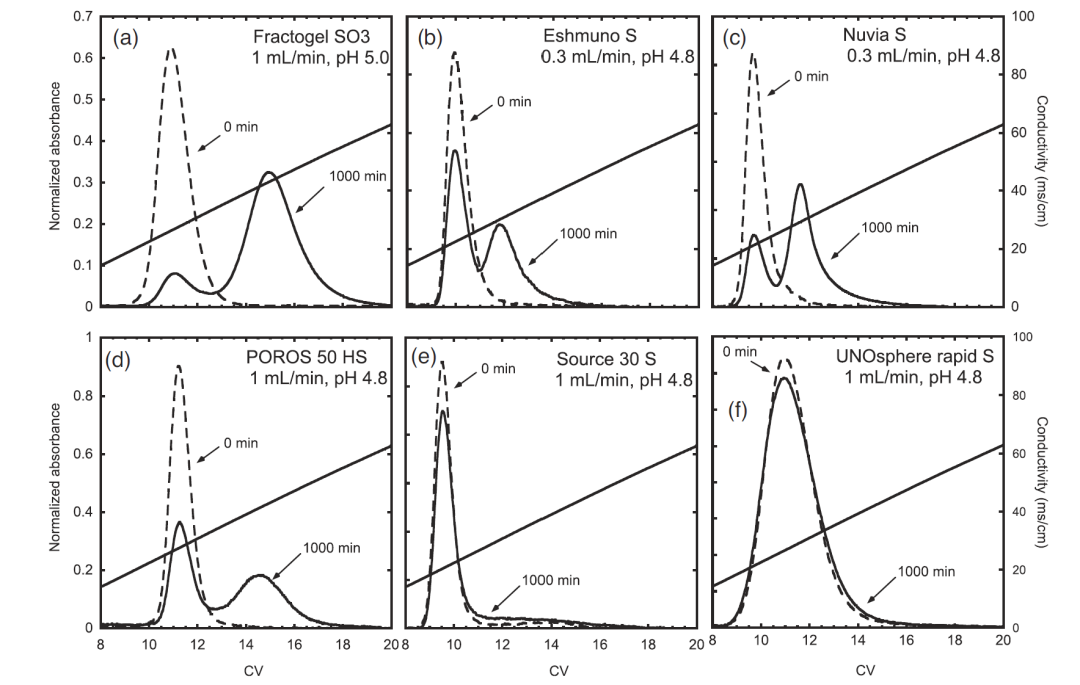
图4

图5

03.填料批次导致的收率大幅下降
在绝大多数的案例中填料批次往往并不是工艺关键参数,但是在极少数案例中,填料批次会极大影响工艺属性表现。这就导致在小试阶段工艺表现正常,而在放大或生产阶段工艺表现异常。在表一中可以看到,Lot2的亲和填料在两个项目中的收率远低于其它批次(质量无差异),所以批次的差异也需要在工艺开发中引起我们的注意。
表1 不同批次亲和填料在不同项目中的表现
04.总结
无论是二硫键还原、洗脱双峰现象还是填批次导致的收率差异,往往发生于放大与生产过程中,不容易在小试阶段被发现,同时这些都是小概率事件,很容易被工艺开发人员忽视。所以有必要在某些情况下建立相应的工艺开发策略,以应对这些小概率事件。

利用我们稳健的下游工艺开发平台,康日百奥可在数周内为客户快速完成抗体和/或治疗性重组蛋白下游工艺的开发。我们可为客户提供灵活的工艺开发服务,既可以转移、开发和优化客户特定工艺,也可为客户开发定制化工艺以满足其特殊需求。我们的目标是通过收率优化和产品纯度改善为客户交付稳健、可放大和低成本的纯化工艺。
服务项目
✔非抗体类蛋白的工艺开发与放大
✔工艺转移
✔工艺表征研究
✔层析填料/膜包使用寿命和清洁研究
✔毫克级/克级样品的制备
康日百奥下游工艺开发工作流程
01.工艺开发和优化

✫康日百奥工艺平台
✫填料和膜筛选
✫具体工艺参数优化
02.工艺确认与技术转移

✫工艺确认研究
✫中间品稳定性研究
✫下游工艺转移文件
03.中试生产

✫病毒清除验证
✫参比品及毒理样品生产
✫临床用样品生产
参考文献
1. Brian O’Mara, Zhong-Hua Gao, Manju Kuruganti, Impact of Depth Filtration on Disulfide Bond Reduction during Downstream Processing of Monoclonal Antibodies from CHO Cell Cultures, iD: 0000-0002-2145-5659.
2. Zhijun Tan, Vivekh Ehamparanathan, Tingwei Ren, On-column disulfide bond formation of monoclonal antibodies during Protein A
chromatography eliminates low molecular weight species and rescues reduced antibodies, 2020, VOL. 12, NO. 1, e1829333 (12 pages).
3. Jing Guo, Giorgio Carta, Unfolding and aggregation of monoclonal antibodies on cation exchange columns: Effects of resin type, load
buffer, and protein Stability, Journal of Chromatography A, 1388 (2015) 184–194.
4. Haibin Luo, Mingyan Cao, Kelcy Newell, Double-peak elution profile of a monoclonal antibody in cation exchange chromatography is
caused by histidine-protonation-based charge variants,Journal of Chromatography A, 1424 (2015) 92–101.
<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论