据药融云数据库统计,2023年3月,共有3款溶瘤病毒产品临床试验获CDE受理,涉及到的公司有滨会生物、中生复诺健和康万达。
溶瘤病毒产品临床试验获CDE受理3月盘点

01.滨会生物
据药融云数据库显示,3月7日,滨会生物提交的"重组人PD-L1/CD3双抗II型单纯疱疹病毒注射液(Vero细胞)"临床试验申请获得受理(受理号:CXSL2300172)。
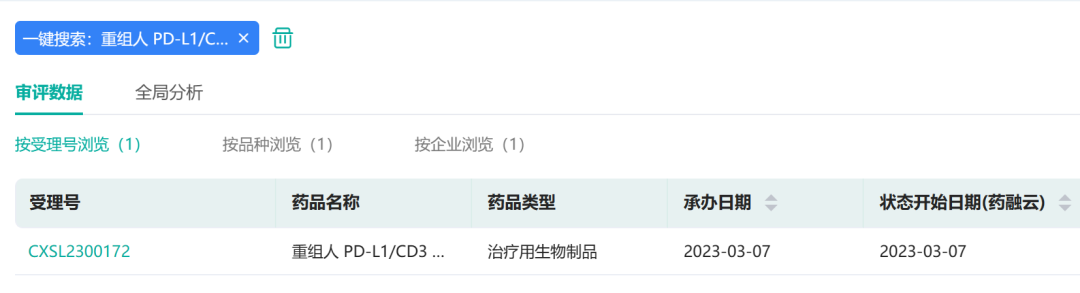
来源:药融云数据库
根据其官网资料显示,这应是该公司另一款新型溶瘤病毒产品BS006。据官网介绍,BS006注射液是一款表达双特异性抗体的新型溶瘤病毒,重组后的Ⅱ型单纯疱疹病毒(HSV2)表达PD-L1/CD3-BsAb分子。
2022年11月,BS006在美获批临床,这是全球首款获批开展临床试验的表达双特异性抗体的溶瘤病毒产品。
02.中生复诺健
据药融云数据库显示,3月17日,中生复诺健溶瘤病毒产品“重组人IL12/15-PDL1B单纯疱疹Ⅰ型溶瘤病毒注射液(Vero细胞)”(产品代号:VG161),再次获得国家药品监督管理局(以下简称“国家药监局”)临床试验批件,本次获批适应症为:VG161联合卡瑞利珠单抗治疗既往至少接受过一线治疗方案治疗的晚期原发性肝细胞癌。
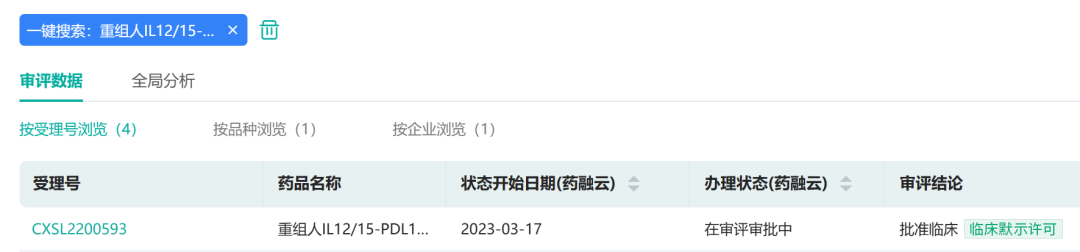
来源:药融云数据库
VG161是基于Ⅰ型单纯疱疹病毒(HSV-1)构建的新型抗肿瘤免疫增强型溶瘤性I型单纯疱疹病毒,它是全球首个进入临床的携带4个外源性免疫调控基因的溶瘤病毒产品。
2020年9月,VG161单药治疗晚期恶性实体瘤获得国家药监局临床批件;2022年4月,VG161联合抗PD-1单抗纳武利尤单抗注射液给药治疗晚期转移性胃或胃食管连接部腺癌获得国家药监局临床批件;2023年3月,VG161联合卡瑞利珠单抗治疗晚期原发性肝细胞癌获得国家药监局临床批件,这也是中生复诺健VG161在国内获得的第3个临床批件。
03.康万达
据药融云数据库显示,3月28日,康万达首款溶瘤痘苗病毒产品hV01获得国家药品监督管理局药品审评中心(CDE)临床试验默示许可,随后将在复旦大学附属肿瘤医院等中心启动临床试验。
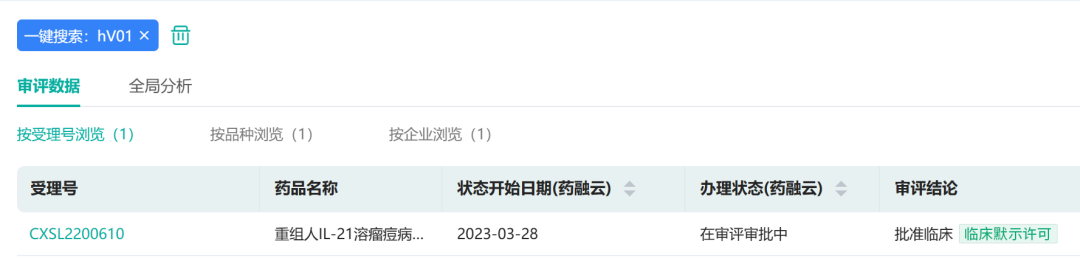
来源:药融云数据库
hV01将作为康万达全球首创的肿瘤系统免疫疗法首个产品,在难治性肿瘤方向开拓单药与特异性联合的技术道路,以期待未来的肿瘤治疗进阶与福音。
康万达产品管线
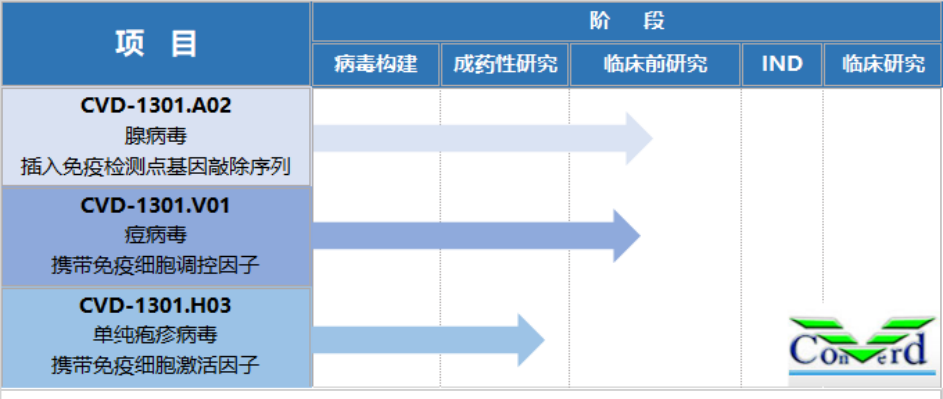
来源:康万达官网
参考资料:
[1] 各公司官网
[2] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论